1. Anwendungsbereich dieses Dokuments
Das vorliegende Dokument enthält die Akzeptierungsvoraussetzungen und -verfahren für Zertifizierungsstellen, die beabsichtigen, die antragstellende Organisation bzw. die nach GMP+ zertifizierten Unternehmen zu zertifizieren. In dem Dokument werden außerdem das seitens GMP+ International durchgeführte Compliance-Assessment in Bezug auf Zertifizierungsstellen / Critical Locations definiert. Ausserdem wird in diesem Dokument der jeweilige Auditzeitaufwand in Tagen angegeben, wobei 1 Tag 8 Stunden entspricht.
2. Normative Verweisungen
Die nachstehenden Dokumente(n), ganz oder teilweise, werden im vorliegenden Dokument als normativ bezeichnet und sind zwingend zu erfüllen,. Im Falle von Verweisen mit Datumsangabe findet ausschließlich die zitierte Ausgabe Anwendung. Im Falle undatierter Verweise gilt die letzte Ausgabe des Dokuments, auf das verwiesen wird (einschließlich alle Änderungen).
- ISO/IEC 17021-1:2015 Konformitätsbewertung - Anforderungen an Stellen, die Managementsysteme auditieren und zertifizieren
- ISO 22003-1:2022(E) Anforderungen an Stellen, die Managementsysteme für die Lebensmittelsicherheit auditieren und zertifizieren.
- F0.1 Rechte und Pflichten
- F0.2 Definitionsverzeichnis
- F0.3 Anwendungsbereiche für die Zertifizierung
- CR2.0 Bewertung und Zertifizierung zusätzlicher Anwendungsbereiche in der Feed Safety Assurance
- CR3.0 Bewertung und Zertifizierung zusätzlicher Anwendungsbereiche in der Feed Responsibility Assurance
3. Grundsätze
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 4.1 |
4. Akzeptierung
4.1. Allgemeines
Eine Zertifizierungsstelle, die eine antragstellende Organisation bzw. ein nach GMP+ zertifiziertes Unternehmen nach einem oder mehreren GMP+-Anwendungsbereichen zertifizieren möchte, muss nachweislich zusätzlich zu den Anforderungen aus den in Abschnitt 2 genannten Dokumenten die im vorliegenden Dokument gestellten Anforderungen erfüllen. Sofern die Zertifizierungsstelle die Anforderungen erfüllt, wird GMP+ International die betreffende Zertifizierungsstelle akzeptieren.
4.2. Akzeptierungsverfahren
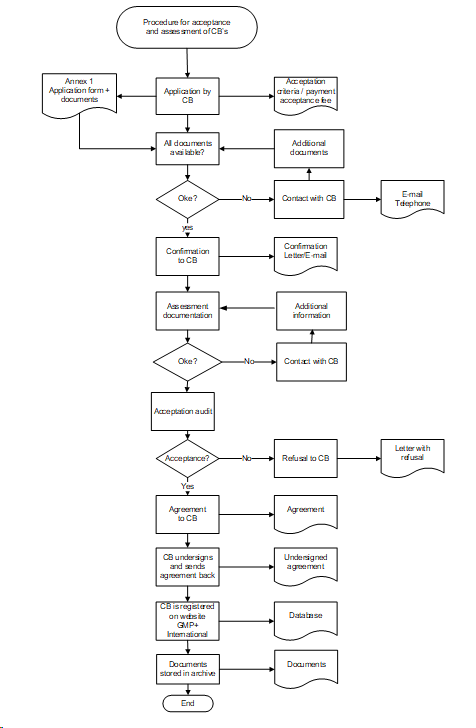
4.2.1. Anwendung
Die antragstellende Zertifizierungsstelle reicht bei GMP+ International mit Hilfe des auf der Website der GMP+ International veröffentlichten Antragsformulars einen Antrag ein. Der Antrag wird in Bearbeitung genommen, sofern:
- das Antragsformular vollständig ausgefüllt ist und alle angeforderten Dokumente empfangen sind
- die Antragsgebühren zur Bearbeitung des Antrags gezahlt worden sind (siehe CR4.0 Gebühren).
- die antragstellende Zertifizierungsstelle muss je von der Zertifizierungsstelle beantragten Anwendungsbereich über zwei zugelassene Auditoren/Inspektoren verfügen. Die antragstellende Zertifizierungsstelle muss ihre Entscheidung gemäß Appendix 1 motivieren und dokumentieren und muss während des Akzeptierungsaudits alle Informationen zur Bewertung bereithalten.
GMP+ International wird den Empfang des Antrags schriftlich bestätigen. Sofern die antragstellende Zertifizierungsstelle nicht innerhalb einer Frist von 26 Wochen nach dem ersten Antrag von GMP+ International akzeptiert werden kann, wird GMP+ International das Akzeptierungsverfahren beenden. Die antragstellende Zertifizierungsstelle darf dann innerhalb eines Jahres nach dem Ablaufdatum kein neues Akzeptierungsverfahren einleiten.
4.2.2. Desk-Assessment
Das Desk-Assessment der angeforderten Dokumente dauert mindestens 4 und höchstens 6 Wochen. GMP+ International informiert die antragstellende Zertifizierungsstelle über die Ergebnisse. Nur nach einem positiven Ergebnis des Desk-Assessments wird ein Akzeptierungsaudit durchgeführt.
4.2.3. Akzeptierungsaudit
Ein Akzeptierungsaudit ist ausschließlich nach einem positiven Ergebnis des Desk-Assessments möglich. Die Dauer des Akzeptierungsaudits vor Ort beträgt mindestens 1 Tag.
Die Auditfeststellungen werden im von GMP+ International erstellten und überprüften Bericht beschrieben.
Die antragstellende Zertifizierungsstelle kann erst nach der Behebung der Auditfeststellungen akzeptiert werden.
4.2.4. Antragstellende Zertifizierungsstellen, die mit Critical Locations arbeiten
Sofern während des Antragsverfahrens festgestellt wird, dass die Zertifizierungsstelle mit einer oder mehr Critical Location(s) arbeitet, gilt Folgendes:
- Die Bewertung der Critical Location(s) gehört zum Akzeptierungsverfahren der antragstellenden Zertifizierungsstelle.
- Für das Akzeptierungsaudit vor Ort bei der Critical Location wird GMP+ International der antragstellenden Zertifizierungsstelle Kosten in Rechnung stellen.
- Die Akzeptierung der antragstellenden Zertifizierungsstelle kann ausschließlich erfolgen, sofern die Critical Location(s) die entsprechenden Anforderungen aus dem GMP+ Feed Certification scheme erfüllen.
4.2.5. GMP+ Feed Certification scheme License Agreement
Sofern die antragstellende Zertifizierungsstelle die Akzeptierungsanforderungen erfüllt:
- fertigt GMP+ International für die antragstellende Zertifizierungsstelle ein GMP+ Feed Certification scheme License Agreement (siehe Appendix 6 dieses Dokuments) aus, das unterzeichnet werden muss
- sendet die Zertifizierungsstelle eines der Originalexemplare nach der Unterzeichnung an GMP+ International zurück. Die Akzeptierung ist vollständig abgerundet, sobald das unterzeichnete und mit einem Datum versehene GMP+ Feed Certification scheme License Agreement vorliegt
- wird GMP+ International die akzeptierte Zertifizierungsstelle und gegebenenfalls deren Critical Location(s) im öffentlichen Bereich der GMP+-Unternehmensdatenbank mit einer Spezifikation der Anwendungsbereiche, für welche die Akzeptierung gilt, veröffentlichen (siehe Appendix 5).
4.3. Akzeptierungsanforderungen
4.3.1. Akkreditierungsanforderungen
Eine Zertifizierungsstelle und ihre kritische(n) Stelle(n) müssen über ein akkreditiertes Qualitätsmanagementsystem für Lebens-/Futtermittel auf der Grundlage von ISO/IEC17021 und ISO22003-1. Ausschließlich sofern die Zertifizierungsstelle und deren Critical Location(s) nur Binnenschifffahrts- oder Küstenschifffahrtstransporte von Futtermitteln zertifizieren, müssen Sie über ein akkreditiertes Managementsystem gemäß ISO/IEC 17020 verfügen und/oder auf internationaler Ebene im Rahmen eines genehmigten Zertifizierungssystems wie ISO 9001 oder gleichwertig arbeiten, wobei nachgewiesen zu sein hat, dass Frachtrauminspektionen (FRI/LCI) gemäß dem zertifizierten Anwendungsbereich gesichert sind.
4.3.2. Management der Unparteilichkeit
| Es gelten die zutreffenden Anforderungen. | |
| ISO/IEC 17021-1:2015 | Artikel 5.2 |
4.3.3. Vertraulichkeit
| Es gelten die zutreffenden Anforderungen. | |
| ISO/IEC 17021-1:2015 | Artikel 8.4 |
4.3.4. Haftung und Finanzierung
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 5.3 |
Außerdem gilt Paragraph 12 des GMP+ Feed Certification scheme License Agreement.
4.3.5. Strukturelle Anforderungen
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 6 |
4.3.6. Anforderungen an Ressourcen
4.3.6.1. Kompetenz des Personals
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 7.1 bis einschließlich 7.4 |
| ISO 22003-1:2022(E) | Artikel 7.1.1 bis einschließlich 7.1.3 |
Zusatzanforderungen an den GMP+-Koordinator/stellvertretenden GMP+-Koordinator, GMP+-Auditor, GMP+-Inspektor und GMP+ technical Reviewer sind in Appendix 1 aufgeführt; Zertifizierungsstellen müssen sicherstellen, dass diese Anforderungen erfüllt werden. Die Zertifizierungsstelle muss ihre Entscheidung gemäß Appendix 1 motivieren und dokumentieren und muss während des Zertifizierungsstellen-Audits alle Informationen zur Bewertung bereithalten.
Ein GMP+-Auditor darf erst GMP+-Audits durchführen, wenn der GMP+-Auditor für den/die betreffenden Anwendungsbereich(e) in der GMP+-Datenbank zugelassen ist.
Ein GMP+ Technical Reviewer darf erst ein technisches Review durchführen, wenn der GMP+ Technical Reviewer + für den betreffenden Anwendungsbereich in der GMP+-Datenbank zugelassen ist.
Die Zertifizierungsstelle muss eine Person als GMP+-Koordinator für die GMP+-Zertifizierungsstelle ernennen. Sie kann auch eine Person als stellvertretenden GMP+-Koordinator für diese Funktion ernennen. Ein Zulassungsantrag für einen GMP+-Koordinator und einen stellvertretenden GMP+-Koordinator muss bei GMP+ International mit Hilfe auf der Website von GMP+ International veröffentlichten Antragsformulars eingereicht werden.
4.3.6.2. Aufgaben des GMP+-Koordinator/stellvertretenden GMP+-Koordinator
Die Aufgaben sind:
- Kontaktperson bei GMP+ International
- Zulassung von GMP+ Auditor, Inspektor und Technical Reviewer.
- Erteilung einer Reduzierung des Auditzeitaufwands.
- Informierung von GMP+ International über (eine) Critical Non-conformity(ies).
- Koordinierung von Untersuchungen.
- Sicherstellung, dass die GMP+-Unternehmensdatenbank auf dem neuesten Stand ist (siehe Anhang 5)
- Interner Erfahrungsaustausch, ein physischer Erfahrungsaustausch ist mindestens einmal in zwei Jahren verpflichtet. Die Teilnahme muss dokumentiert werden. Der Inhalt des internen Erfahrungsaustauschs muss über eine Präsentation oder ein Protokoll nachgewiesen werden. Die Harmonisierung der Auditoren durch den Koordinator kann unter den folgenden Bedingungen an externe Parteien delegiert werden:
- Wird die Schulung ausgelagert, muss der ZertStellen-Koordinator gemeinsam mit der vergebenden Partei den Inhalt festlegen, um eine ausreichende Tiefe zu gewährleisten.
- Die Schulungsinhalte müssen verfügbar und bei CB Office Audits überprüfbar sein.
Die Zertifizierungsstelle muss für den Fall, dass der GMP+-Koordinator/stellvertretende GMP+-Koordinator Verantwortlichkeiten an eine befugte Person delegiert, ein Verfahren festlegen, wobei für die Aufgaben 1 bis 4 eine Ausnahmen gilt.
Die Position des GMP+-Koordinators/stellvertretenden Koordinators muss mit einer Person besetzt werden, die mit dem Standort und der anerkannten Zertifizierungsstelle verbunden ist.
Dies bedeutet:
- Verpflichtung gegenüber der Zertifizierungsstelle und dem GMP+-Zertifizierungsprozess
- Der GMP+-Koordinator/stellvertretende Koordinator muss ein klares und nachgewiesenes Engagement für die Unterstützung des GMP+-Zertifizierungsprozesses haben.
- Dadurch wird sichergestellt, dass der GMP+-Koordinator/stellvertretende Koordinator sich aktiv mit dem GMP+-Zertifizierungsprozess beschäftigt und auf dessen Verbesserung hinarbeitet.
- Kenntnis der akzeptierten Anwendungsbereiche der Zertifizierungsstelle
- Der GMP+-Koordinator/stellvertretende Koordinator muss ein tiefes Verständnis der GMP+-Anforderungen des/der von der Zertifizierungsstelle akzeptierten Anwendungsbereichs/-bereiche haben.
- Dadurch wird sichergestellt, dass der GMP+-Koordinator/stellvertretende Koordinator die Zertifizierungsanforderungen im jeweiligen Kontext interpretieren und anwenden kann, um die Konsistenz und Integrität des Zertifizierungsprozesses zu wahren, und dies den GMP+-Auditoren und den zuständigen Mitarbeitern mitteilt.
- Repräsentant der Zertifizierungsstelle
- Der GMP+-Koordinator/stellvertretende Koordinator muss als effektiver Vertreter der Zertifizierungsstelle fungieren, der befugt ist, die Einhaltung der GMP+-Anforderungen sicherzustellen.
- Dadurch wird sichergestellt, dass der GMP+-Koordinator/stellvertretende Koordinator Korrektur- und Vorbeugungsmaßnahmen durchführen muss, die die Einhaltung des GMP+ FC-Schemas gewährleisten.
- Erheblicher Einfluss auf das Dokumentenmanagement und die internen Abläufe
- Der GMP+-Koordinator/stellvertretende Koordinator muss eine aktive Rolle spielen und die Befugnis haben, die GMP+-Dokumentation und die internen Prozesse der Zertifizierungsstelle zu überprüfen und zu aktualisieren, und sicherstellen, dass die internen Systeme für die Dokumentation den GMP+-Anforderungen entsprechen.
- Dadurch wird sichergestellt, dass die GMP+-Dokumentation den GMP+-Anforderungen entspricht und vollständig in die operativen Prozesse der Zertifizierungsstelle integriert ist.
- Effiziente und effektive Kommunikation
- Der GMP+-Koordinator/stellvertretende Koordinator muss zugänglich sein und bei den GMP+-Aktivitäten eine deutliche Präsenz zeigen. Dazu gehören regelmäßige interne Besprechungen oder Konsultationen auf Abruf zur Klärung von Zertifizierungsangelegenheiten.
- Dadurch wird sichergestellt, dass eine effiziente und effektive Kommunikation stattfindet und sichert die Fortführung des GMP+-Zertifizierungsprozesses.
4.3.7. Informationsanforderungen
4.3.7.1. Öffentliche Informationen
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 8.1 |
Beim Abschluss eines GMP+-Zertifizierungsvertrags mit einer antragstellenden Organisation muss die Zertifizierungsstelle und/oder Critical Location unverzüglich die Unternehmensdaten im Sinne von Appendix 5 des vorliegenden Dokuments in die GMP+-Unternehmensdatenbank:
- Im Falle einer Matrixzertifizierung oder einer Zertifizierung eines Zugmaschinen mit Fahrer, muss der Hauptstandort in der GMP+- Unternehmensdatenbank registriert und an den Matrixzertifizierungsstandort bzw. Zugmaschinen mit Fahrer gekoppelt werden.
- Nach einem erfolgreichen Erstzertifizierungsaudits müssen die Zertifizierungsanwendungsbereiche hinzugefügt werden.
Die Zertifizierungsstelle und/oder Critical Location muss die GMP+-Datenbank im Falle von Änderungen der oben und in Appendix 5 genannten Informationen innerhalb von 2 Wochen anpassen.
Sofern sich der Firmenname und/oder der Sitz bzw. die juristische Person der Zertifizierungsstelle oder ihrer Critical und Non-Critical Location ändern oder sofern ein Standort geschlossen wird oder dessen GMP+-Tätigkeiten eingestellt werden, ist die Zertifizierungsstelle verpflichtet, GMP+ International darüber 3 Monate zuvor zu informieren.
4.3.7.2. Informationsaustausch zwischen einer Zertifizierungsstelle und ihren Kunden
| Es gelten die zutreffenden Anforderungen aus: | |
| ISO/IEC 17021-1:2015 | Artikel 8.5.1 und 8.5.2 |
Die Zertifizierungsstelle muss sämtliche zutreffende Dokumentation bzw. Information zur Zertifizierung während mindestens sechs Jahren aufbewahren.
4.3.8. GMP+ International Harmonisierung
GMP+ International veranstaltet 2 Harmonisierungstreffen zur Feed Safety Assurance (FSA) und 1 Harmonisierungstreffen zur Feed Responsibility Assurance (FRA).
Auf der Grundlage der Akzeptierung der Zertifizierungsstelle muss bei jedem Harmonisierungstreffen muss der GMP+-Koordinator oder stellvertretende GMP+-Koordinator der akzeptierten Zertifizierungsstelle anwesend sein. Sofern es für eine Zertifizierungsstelle nicht genug relevante Tagesordnungspunkte gibt, kann GMP+ International eine individuelle Befreiung von der Anwesenheitspflicht beschließen.
Jede Zertifizierungsstelle ist verpflichtet, GMP+ International jährlich rechtzeitig mindestens 1 Fallstudie zu FSA und 1 Fallstudie zu FRA vorzulegen, die während des Harmonisierungstreffens besprochen werden kann.
4.3.9. Verfahren und Dokumente zur GMP+-Zertifizierung
Die Zertifizierungsstelle muss über (ein) aktuelle(s) dokumentierte(s) Verfahren und Dokumente/Vorlagen verfügen, in dem/denen das GMP+-Zertifizierungsverfahren beschrieben wird (Antrag bis zur Ausstellung des Zertifikats). Die Zertifizierungsstelle muss diese(s) dokumentierte(n) Verfahren und Dokumente/Vorlagen im QM-System integriert haben.
Für die Verwaltung der dokumentierten Verfahren und Dokumente/Vorlagen muss die Zertifizierungsstelle gegebenenfalls Folgendes regeln:
- Verteilung, Zugriff, Auffindung und Verwendung
- Aufbewahrung und Erhalt, einschließlich der Erhaltung der Lesbarkeit
- Verwaltung von Änderungen (z. B. Versionskontrolle)
- Lagerung und Entsorgung.
Im Falle von Änderungen der Zertifizierungsanforderungen muss die Zertifizierungsstelle diese spätestens am Implementierungsdatum verwirklichen.
5. Compliance-Assessment
5.1. Allgemeines
GMP+ International beaufsichtigt die Einhaltung der in den zutreffenden CR-Dokumenten, F-Dokumenten und im unterzeichneten Lizenzvertrag festgelegten Anforderungen durch die Zertifizierungsstellen.
Die im vorliegenden Dokument festgelegten Kriterien werden für Compliance-Assessments und zur Festlegung von Sanktionen verwendet.
5.2. Compliance-Assessment von Zertifizierungsstellen, Critical Location(s) und GMP+-Auditoren/Inspektoren
Das Compliance-Assessment der Zertifizierungsstellen und Critical Location(s), die GMP+ International ausführt, beinhaltet Folgendes:
5.2.1. Compliance-Desk-Assessment
Das Compliance-Desk-Assessment ist um zu bestimmen, ob die Zertifizierungsstelle und die Critical Location(s)und Non-Critical Location(s) die im GMP+ Feed Certification scheme festgelegten Anforderungen erfüllen.
5.2.2. Compliance-Audits:
Es finden die nachstehenden Compliance-Audits Anwendung.
5.2.2.1. Witness-Audits (WA-Bericht)
GMP+ International beaufsichtigt die GMP+-Auditors/Inspektoren, indem sie deren Arbeitsweise und deren Methode zur Klassifizierung ihrer Non-Conformities während der Durchführung ihres Audits bewerten. Sofern der Auditor von GMP+ International feststellt, dass während des Audits ein Risiko im Hinblick auf die Futtermittelsicherheit bzw. Nachhaltigkeit von Futtermitteln nicht identifiziert worden ist, wird der GMP+-Auditor vor dem Abschlussgespräch vom Auditor von GMP+ International informiert, um das Vorliegen eines Risikos im Hinblick auf die Futtermittelsicherheit bzw. Nachhaltigkeit von Futtermitteln zu bestätigen. Während eines Wiederholungsaudits bzw. einer Wiederholungsinspektion kann GMP+ International beschließen, ein Witness-Audit zu dem betreffenden Auditor/Inspektor durchzuführen.
5.2.2.2. Parallel-Audits (PA-Bericht)
GMP+ International führt bei nach GMP+ zertifizierten Unternehmen Parallel-Audits durch, um die Methode zur Planung, Ausführung und Berichterstattung eines Audits durch die Zertifizierungsstelle zu verifizieren. Das Parallel-Audit erfolgt, nachdem die Zertifizierungsstelle ihr Audit durchgeführt hat.
5.2.2.3. CB-Office-Audits (CB-Bericht)
GMP+ International führt bei den Zertifizierungsstellen mindestens einmal jährlich ein Audit durch, um die Implementierung der Anforderungen aus dem GMP+ Feed Certification scheme zu bewerten. Dieses Audit umfasst eine vollständige Überprüfung hinsichtlich sämtlicher Anforderungen. Der Mindestzeitaufwand beträgt einen Tag. Es gilt das Referenzdokument zur Beschreibung von NCRs (Appendix 4.2).
5.2.2.4. Critical-Location(s)-Audit (CL- Bericht)
GMP+ International führt mindestens einmal in 2 Jahren ein Audit der Critical Location(s) durch, um die Implementierung der Anforderungen aus dem GMP+ Feed Certification scheme zu bewerten. Der Mindestzeitaufwand beträgt einen Tag.
5.2.2.5. Non-Critical Location(s) Audit (NCL Bericht)
Auf der Grundlage objektiver Nachweise aus einem CB-Office-Audit kann GMP+ International ein Non-Critical Location-Audit durchführen, um die Implementierung der Anforderungen aus dem GMP+ Feed Certification scheme zu bewerten. Der Mindestzeitaufwand beträgt einen Tag.
5.2.3. Analyse
5.2.3.1. Retrospektive Analyse
Retrospektive Analyse des nach GMP+ zertifizierten Unternehmens bzw. GMP+-Auditors, die aufgrund spezieller Ereignisse und auf nicht regelmäßiger Grundlage erfolgt:
a. Retrospektive Analyse des Zertifizierungsverfahrens (RAC-Bericht)
Es handelt sich um eine Analyse der Berichte zu allen Zertifizierungsaudits und, sofern verfügbar, auch zu den Compliance-Audits, die in den vergangenen 36 Monaten bei einem bestimmten Unternehmen durchgeführt worden sind.
b. Retrospektive Analyse eines GMP+-Auditors (RAA-Bericht)
Es handelt sich um eine Analyse der Berichte zu allen von einem bestimmten GMP+-Auditor durchgeführten Zertifizierungsaudits für eine Reihe von GMP+ International festzulegenden Berichte, die sich auf einen oder mehr zutreffende Anwendungsbereiche beziehen.
5.2.3.2. Overall Analysis
Overall Analysis der Zertifizierungsleistung (OA-Bericht).
Es handelt sich um eine jährliche Analyse der Leistung einer Zertifizierungsstelle während der letzten drei Kalenderjahre auf der Grundlage mindestens folgender Parameter:
- Festgestellte Non-conformities je GMP+-Auditor
- Feststellungen/NCRs aus GMP+-Compliance-Audits
- Teilnahme an und Eingaben für Harmonisierungstreffen
- Prüfungsergebnisse von GMP+-Auditoren
- Compliance-Assessment der Critical Location(s), sofern zutreffend.
Das Endergebnis der Overall Analysis kann zu einem zusätzlichen Compliance-Assessment der Zertifizierungsstelle und/oder Critical Location(s) führen. Die Kosten für das zusätzliche Compliance-Assessment können der Zertifizierungsstelle in Rechnung gestellt werden. Sofern GMP+ International eine Maßnahmeplan bzw. ein Verbesserungsplan fordert, ist die Zertifizierungsstelle verpflichtet, eine solche Maßnahmeplan bzw. einen solchen Verbesserungsplan innerhalb der von GMP+ International erbetenen Frist einzusenden.
5.2.4. Prüfung
Die Prüfung von GMP+-Auditoren, technical Reviewers und Inspektoren ist ein Instrument zur Messung des Fachwissens und Wissensanwendung der GMP+-Auditoren, technical Reviewers und Inspektoren gemäß den Anforderungen des GMP+ Feed Certification scheme einschließlich der Klassifizierung von Non-conformities.
5.2.5. Bewertung der Berichte
Auf der Grundlage willkürlicher Stichproben bewertet GMP+ International den GMP+-Auditbericht bzw. die Checkliste zu den Audits, welche die Zertifizierungsstellen im Rahmen des GMP+ Feed Certification scheme durchgeführt haben. Die Zertifizierungsstelle muss die Informationen sofort auf entsprechende Aufforderung hin zur Verfügung stellen.
5.3. Feststellung und Aufzeichnung der Non-conformities
Ergänzend zu den Paragraphen 5.2.1, 5.2.2, 5.2.3.1 und 5.2.5 aus Appendix 4 gilt Folgendes:
Nachdem GMP+ International das Compliance-Assessment ausgeführt hat, erstellt der Auditor von GMP+ International die NCRs und übermittelt er diese dem GMP+-Koordinator und/oder dem stellvertretenden GMP+-Koordinator der Zertifizierungsstelle. GMP+ International ist dafür verantwortlich, dass die festgestellten NCRs gerechtfertigt und ordentlich klassifiziert werden. Während des Critical-Location-Audits festgestellte Non-conformities werden immer der verantwortlichen Zertifizierungsstelle übermittelt.
NCRs können nur aufgehoben werden, wenn die betreffende Zertifizierungsstelle eine Ursachenanalyse durchführt und Korrekturmaßnahmen und/oder Vorbeugungsmaßnahmen ergreift. Erforderlichenfalls muss die betreffende Zertifizierungsstelle GMP+ International objektive Beweise vorlegen.
GMP+ International bezeichnet diese Maßnahmen als den Corrective Action Report (im Folgenden als CAR bezeichnet).
Minor und/oder Major Non-conformities:
Der Auditor von GMP+ International und der (technical) Reviewer von GMP+ International sind für die Vervollständigung des Compliance-Berichts, die Beurteilung des/der CAR(s) und die Aufhebung des/der NCR(s) verantwortlich.
Critical Non-conformities:
GMP+ International ist für das Treffen der Entscheidung zur Aufhebung und/oder Herauf- oder Herabstufung der NCR(s) und für die Festlegung des endgültiges Assessment-Reports verantwortlich.
5.4. Berichterstattung
Für alle in Paragraph 5.2 genannten Bewertungen (außer der Bewertung aus Paragraph 5.2.4) wird der Zertifizierungsstelle ein Bericht in der englischen Sprache übermittelt. Außerdem kann der Compliance-Report für alle in Paragraph 5.2 genannten Audittypen (außer dem Audittyp aus Paragraph 5.2.4) auch in der deutschen oder niederländischen Sprache an die Zertifizierungsstelle übermittelt werden.
5.5. Maßnahmen und Sanktionen
Sofern GMP+ International feststellt, dass eine Zertifizierungsstelle die Anforderungen und Verpflichtungen aus dem GMP+ Feed Certification scheme oder dem GMP+ Feed Certification scheme Licence Agreement, nicht erfüllt, wird sie der Zertifizierungsstelle eine der nachstehend zu Buchstabe a. bis e. genannten Maßnahmen oder Sanktionen auferlegen. Die Zertifizierungsstelle wird erforderlichenfalls über ein offizielles Schreiben informiert.
- eine Frist, innerhalb derer die Zertifizierungsstelle / Critical Location die Anforderungen aus dem GMP+ Feed Certification scheme erfüllen muss, und die Aufforderung an die Zertifizierungsstelle, innerhalb einer festgelegten Frist einen Corrective Action Report vorzulegen;
- dass das GMP+ Feed Certification scheme Licence Agreement mit der Zertifizierungsstelle nicht verlängert wird;
- dass das GMP+ Feed Certification scheme Licence Agreement für einen Zeitraum von höchstens 3 Monaten ausgesetzt wird, wodurch es für die Critical Location undNon-Critical Location automatisch nicht gestattet ist, während die gleiche Periode GMP+-Tätigkeiten durchzuführen;
- dass das GMP+ Feed Certification scheme Licence Agreement möglicherweise nach der Aussetzung beendet wird, wodurch die Critical Location undNon-Critical Location automatisch keine GMP+-Aktivitäten mehr durchführen dürfen;
- dass die zu den Buchstaben b, c und d genannte Nichtverlängerung, Aussetzung und Beendigung veröffentlicht wird.
Während einer Aussetzung im Sinne von Buchstabe c. muss die Zertifizierungsstelle sicherstellen, dass alle ihre Verpflichtungen im Rahmen des GMP+ Feed Certification scheme von einer anderen nach GMP+ akzeptierten Zertifizierungsstelle übernommen werden.
Infolge der Nichtverlängerung/Beendigung im Sinne der Buchstaben b. und d. wird die betreffende Zertifizierungsstelle für einen Zeitraum von mindestens einem Jahr von der Teilnahme am GMP+ Feed Certification scheme ausgeschlossen. GMP+ International informiert die beteiligten nach GMP+ zertifizierten Unternehmen.
Appendix 1: Kompetenz des Personals
Appendix 1.1 GMP+ Auditor FSA
| Stellung: GMP+ Auditor FSA | ||
| | Auditorenanwärter | Zugelassener Auditor |
| Ausbildung |
| Siehe Auditorenanwärter |
| Kenntnisse |
Außerdem:
| Siehe Auditorenanwärter |
| Auditfertigkeiten |
| Siehe Auditorenanwärter |
| Auditerfahrung |
und
|
|
| Berufserfahrung |
Ausnahme:
| Siehe Auditorenanwärter |
| Interner Erfahrungsaustausch | Jeder GMP+-Auditor-Anwärter muss nachweislich eine erstmalige Schulung in Bezug auf den/die betreffenden Anwendungsbereich(e) absolviert haben. |
|
| Prüfung | Erfolgreiche Absolvierung der entsprechenden Prüfungen. Es gelten die GMP+-Prüfungsvorschriften und Appendix 2.1. | Siehe Auditorenanwärter |
| * gilt auch für den Technischen Experten | ||
Appendix 1.2 GMP+ Auditor FRA
| Stellung: GMP+ Auditor FRA | ||
| | Auditorenanwärter | Zugelassener Auditor |
| Ausbildung |
| Siehe Auditorenanwärter |
| Kenntnisse | Kenntnisse und Fertigkeiten in Bezug auf Methoden und Techniken, welche sich auf die Bewertung von:
Für Audits von MI5.1, MI5.2, MI5.3 und MI5.6 muss der GMP+-Auditor:
Zum Auditieren von MI5.4 GMO Controlled muss der GMP+-Auditor über:
| Siehe Auditorenanwärter |
| Auditfertigkeiten |
| Siehe Auditorenanwärter |
| Auditerfahrung |
und
|
|
| Berufserfahrung |
| Siehe Auditorenanwärter |
| Interner Erfahrungsaustausch | Jeder GMP+-Auditor-Anwärter muss nachweislich eine erstmalige Schulung in Bezug auf den/die betreffenden Anwendungsbereich(e) absolviert haben. Siehe „Kenntnisse“. |
|
| Prüfung | Nicht zutreffend | Nicht zutreffend |
| 1 Anforderungen an den Ausbilder: Der Ausbilder muss über ein Zeugnis der Schulung für MI5.1, MI5.2, MI5.3 und MI5.6 verfügen, die in der Vergangenheit von GMP+ International gegeben worden ist, und/oder der Ausbilder hat die „RTRS endorsed“-Schulung erfolgreich absolviert, und es muss sich bei ihm um einen von GMP+ zugelassenen Auditor für einen der geltenden FRA-Anwendungsbereiche handeln. 2 Anforderungen an den Ausbilder: Der Ausbilder muss immer im Besitz eines gültigen VLOG „Ohne Gentechnik“-Schulungszeugnisses sein, und es muss sich bei ihm um einen von GMP+ zugelassenen Auditor für MI5.4 handeln. | ||
Appendix 1.3 GMP+ Technical Reviewer FSA/FRA
| Stellung: GMP+Technical Reviewer FSA/FRA | ||
| | Technical-Reviewer-Anwärter | Zugelassener Technical Reviewer |
| Ausbildung |
| Siehe Technical-Reviewer-Anwärter |
| Kenntnisse |
Ergänzend zu FSA:
Ergänzend zu FRA:
| Siehe Technical-Reviewer-Anwärter |
| Auditfertigkeiten | Schulung zum Lead-Assessor oder FSSC-Lead-Assessor (mindestens 40 Stunden, IRCA-Anerkennung oder nachweislich gleichwertig) Gilt nicht für die Berichtsprüfung zu TS3.3 Binnen- und Küstenschifffahrtstransporten von Futtermitteln | Siehe Technical-Reviewer-Anwärter |
| Review-/Auditerfahrung |
| Durchführung/Beobachtung von mindestens 5 Audits je Anwendungsbereich pro Jahr, für den der technical Reviewer zugelassen ist, oder Prüfung von 5 Berichten / Inspektionschecklisten für den betreffenden Anwendungsbereich. |
| Berufserfahrung |
Ausnahme:
| Siehe Technical-Reviewer-Anwärter |
| Interner Erfahrungsaustausch | Jeder Technical-Reviewer-Anwärter für GMP+ muss nachweislich eine erstmalige Schulung in Bezug auf den/die betreffenden Anwendungsbereich(e) absolviert haben. |
|
| Prüfung | Erfolgreiche Absolvierung der entsprechenden Prüfungen. Es gelten die GMP+-Prüfungsordnung und Appendix 2.1. | Siehe Technical-Reviewer-Anwärter |
Appendix 1.4 GMP+-Inspektor
| Stellung: GMP+-Inspektor | ||
| | Inspektorenanwärter | Zugelassener Inspektor |
| Ausbildung | Erfolgreich absolvierte Ausbildung an einer mittleren berufsbildenden Schule oder mindestens ein gleichwertiges Erfahrungsniveau. | Siehe Inspektorenanwärter |
| Kenntnisse |
| Siehe Inspektorenanwärter |
| Inspektionserfahrung |
| Mindestens 5 Vor-Ort-Inspektionen pro Jahr
|
| Berufserfahrung | Berufserfahrung in der Futtermittel- oder Lebensmittelwirtschaft in einer relevanten Funktion (beispielsweise Durchführung einer LCI). | Siehe Inspektorenanwärter |
| Interner Erfahrungsaustausch | Jeder Inspektor-Anwärter muss nachweislich eine erstmalige Schulung absolviert haben. | Jeder Inspektor wohnt je Kalenderjahr mindestens 8 Stunden einen internen Erfahrungsaustausch bei, der von der Zertifizierungsstelle veranstaltet wird.
|
| Prüfung | Erfolgreiche Absolvierung der entsprechenden Prüfungen. Es gelten die GMP+-Prüfungsordnung. | Siehe Inspektorenanwärter |
Appendix 1.5 GMP+-Koordinator
| Stellung: GMP+-Koordinator, der keine GMP+-Audits durchführt | ||
| | (Stellvertretender) GMP+-Koordinatorenanwärter | Zugelassener (stellvertretender) GMP+-Koordinator |
| Ausbildung | Bachelor-Zeugnis oder mindestens gleichwertiges Erfahrungsniveau. | Siehe (stellvertretender) GMP+-Koordinatoranwärter |
| Kenntnisse |
| Siehe (stellvertretender) GMP+-Koordinatoranwärter |
| Auditfertigkeiten | Schulung zum Lead-Assessor oder FSSC-Lead-Assessor (mindestens 40 Stunden, IRCA-Anerkennung oder nachweislich gleichwertig) | Siehe (stellvertretender) GMP+-Koordinatoranwärter |
| Auditerfahrung | Es müssen 7 GMP+-Vor-Ort-Audits oder Inspektionen durchgeführt und/oder als Beobachter beigewohnt werden, es gelten außerdem Audits für Zertifizierungssysteme im Sinne von GMP+ TS1.2 Beschaffung. | Pro 24 Monate müssen 7 GMP+-Audits /Inspektionen durchgeführt und/oder als Beobachter beigewohnt werden, es gelten außerdem Audits für Zertifizierungssysteme im Sinne von GMP+ TS1.2 „Beschaffung“. |
| Berufserfahrung | Berufserfahrung in der Futtermittel- oder Lebensmittelwirtschaft in einer relevanten Funktion (beispielsweise Qualitätssicherung, Produktion, Beratung zu Feed Safety Management Systems, Labor). | Siehe (stellvertretender) GMP+-Koordinatoranwärter |
| Interner Erfahrungsaustausch | Jeder Koordinator/stellvertretende Koordinator muss nachweislich eine erstmalige Schulung absolviert haben. | Der Koordinator stellvertretende Koordinator muss pro Kalenderjahr je nach der Anzahl Anwendungsbereiche, für welche die betreffende Zertifizierungsstelle akzeptiert ist, einen Erfahrungsaustausch von mindestens 8 und höchstens 24 Stunden beiwohnen. Diese Schulung kann an keine andere Person delegiert werden.
|
| Prüfung | Nicht zutreffend | Nicht zutreffend |
Appendix 2: Tabelle mit Befreiungen
In dieser Tabelle sind die Befreiungen in Bezug auf die Prüfung, Zulassung und interne Harmonisierung angegeben. Zu Jedem GMP+-Anwendungsbereich, der oben in der Tabelle steht, wird mit einem „X“ die Befreiung für den jeweiligen zutreffenden Anwendungsbereich in der linken Spalte angegeben. Die Tabelle gilt nicht umgekehrt.
Appendix 2.1 Tabelle mit Befreiungen von der Zulassung, internen Harmonisierung und Prüfung
| | Herstellung von Misch-futter-mitteln | Herstellung von Vor- mischungen | Herstellung von Zusatz-stoffen | Herstellung von Einzel-futter-mitteln | Handel mit Futter-mitteln | Lagerung und Umschlag von Futter-mitteln | Straßen-transport von Futter-mitteln | Befrachtung | Straßen-transport von Futter-mitteln & Befrachtung | Laborunter-suchungen |
| Herstellung von Mischfuttermitteln1 | | X | | | | | | | | |
| Herstellung von Mischfuttermitteln - Heimtierfuttermittel Herstellung von Mischfuttermitteln - GMO Controlled | X | X | | | | | | | | |
| Herstellung von Vormischungen1 | X | | | | | | | | | |
| Herstellung von Vormischungen - GMO Controlled | X | X | | | | | | | | |
| Herstellung von Zusatzstoffen1 | | | | X | | | | | | |
| Herstellung von Zusatzstoffen - GMO Controlled | | | X | X | | | | | | |
| Herstellung von Einzelfuttermitteln1 | | | X | | | | | | | |
| Herstellung von Einzelfuttermitteln - Heimtierfuttermittel Herstellung von Einzelfuttermitteln - GMO Controlled | | | X | X | | | | | | |
| Handel mit Futtermitteln | X | X | X | X | | | | | | |
| Handel mit Futtermitteln - Heimtierfuttermittel Handel an viehhaltende Betriebe Handel mit Futtermitteln - GMO Controlled | X | X | X | X | X | | | | | |
| Lagerung und Umschlag von Futtermitteln | X | X | X | X | | | | | | |
| Lagerung und Umschlag von Futtermitteln - GMO Controlled | X | X | X | X | | X | | | | |
| Straßentransport von Futtermitteln - GMO Controlled | | | | | | | X | | | |
| Befrachtung bei Küstenschifffahrtstransporten Befrachtung bei Binnenschifffahrtstransporten Befrachtung bei Seeschifffahrtstransporten Befrachtung bei Schienentransporten | | | | | | | | X | | |
| Befrachtung bei Straßentransporten | | | | | | | X | | | |
| Antibiotikafreie Produktionslinie(n) | X | X | X | X | | | | | | |
| Antibiotikafreier Produktionssstandort | X | X | X | X | | | | | | |
| Carbon footprint of feed (CO2-Bilanz) | X | X | X | X | | | | | | |
| Dioxinüberwachung in Legehennenfutter | X | | | | | | | | | |
| QM-Milch | X | X | X | X | X | | | | | |
| RTRS | X | X | X | X | X | | | | | |
| Nachhaltiges Milchviehfutter | X | | | | X | | | | | |
| Nachhaltigen Futtermitteln | X | X | X | X | X | | | | | |
| Nachhaltiges Schweine- & Geflügelfutter | X | | | | X | | | | | |
| Registriertes Labor | | | | | | | | | | X |
| Schienentransport von Futtermitteln | | | | | | | | | X | |
| 1 Gilt nicht für Prüfungen | ||||||||||
Appendix 2.2 Tabelle mit Befreiungen in Bezug auf den Auditturnus
Bezüglich des Erhalts einer Zulassung für einen Auditor / Technical Reviewer / Inspektor werden hinsichtlich der Anforderung von mindestens 5 Audits pro Jahr und pro Anwendungsbereich die Audits / Berichtsprüfungen / Inspektionen, die bei den betreffenden Unternehmen der anerkannten Zertifikate im Sinne von TS1.2 Beschaffung stattfinden, berücksichtigt. Ergänzend kann auch die nachstehende Tabelle Anwendung finden.
| Ein Audit für | Gilt auch als ein Audit für: |
| GMP+-Anwendungsbereich
| GMP+-Anwendungsbereich
|
| GMP+-Anwendungsbereich
| GMP+-Anwendungsbereich
|
| GMP+-Anwendungsbereich
| GMP+-Anwendungsbereich
|
| GMP+-Anwendungsbereich
| GMP+-Anwendungsbereich
|
| GMP+ Anwendungsbereich :
| GMP+ Anwendungsbereich
|
| GMP+ Anwendungsbereich :
| GMP+ Anwendungsbereich
|
| GMP+ Anwendungsbereich :
| GMP+ Anwendungsbereich
|
| GMP+ Anwendungsbereich :
| GMP+ Anwendungsbereich
|
| GMP+-Anwendungsbereich
| GMP+-Anwendungsbereich
|
| VLOG – ‘Ohne Gentechnik’ Produktions und Zertifizierungs- Standard | GMP+-Anwendungsbereich
|
| OQUALIM-STNO Technical Platform “GMO free fed” | GMP+-Anwendungsbereich
|
| Hinweis: Die Anwendungsbereiche in der linken Spalte dieser Tabelle gelten auch für die Anwendungsbereiche in der rechten Spalte, aber nicht umgekehrt. | |
Appendix 3: Verfahren zur Akzeptierung und Bewertung von Zertifizierungsstellen
Appendix 4: Bewertungskriterien
Appendix 4.1 Bewertungskriterien und Sanktionen
Non-conformities müssen auf folgender Grundlage klassifiziert werden:
- die allgemeinen Bewertungskriterien im Sinne des vorliegenden Appendix.
- Es müssen mindestens die genannten Sanktionen auferlegt werden. GMP+ International darf strengere Sanktionen auferlegen.
Die CARs müssen GMP+ International spätestens zwei Wochen vor der Frist zugeschickt werden. GMP+ International ist für das Treffen der Entscheidung verantwortlich, ob die Non-conformities aufgehoben werden.
| Klassifizierung: Minor Non-conformity | |||
| Beschreibung | Konsequenz | Frist zur Behebung | |
| Zertifizierungsstellen
| < 5 Non-conformities | Erfüllung der Akzeptierungsanforderugen | Innerhalb von höchstens 6 Monaten (Entscheidung durch GMP+ Int.) |
| ≥5 Non-conformities | Nichterfüllung der Akzeptierungsanforderungen | Innerhalb von 10 Wochen | |
| Klassifizierung: Major Non-conformity | ||
| Beschreibung | Konsequenz | Frist zur Behebung |
| Zertifizierungsstellen
| Nichterfüllung der Akzeptierungsanforderungen | Innerhalb von 6 Wochen |
| Klassifizierung: Critical Non-conformity: | ||
| Beschreibung | Konsequenz | Frist zur Behebung |
| Zertifizierungsstellen
| Niveau 1: Die GMP+-Akzeptierung kann ausschließlich fortgesetzt werden, wenn die NCR aufgehoben wird. | Innerhalb von 1 Woche |
| Niveau 2: Die GMP+-Akzeptierung wird für höchstens 3 Monate ausgesetzt. | ||
| Niveau 3: Die GMP+-Akzeptierung wird beendet. | ||
| Zertifizierungsstellen
| Niveau 1: Die GMP+-Akzeptierung wird für höchstens 3 Monate ausgesetzt. | |
| Niveau 2: Die GMP+-Akzeptierung wird beendet. | ||
Appendix 4.2 Referenzdokument zur Beschreibung von NCRs für nach GMP+ akzeptierte Zertifizierungsstellen
| Art. Nr. CR- Dokumente | Ref. Nr. | NCR’s CB audits / Compliance Desk Assessment / Report assessment / Retrospective analysis |
| | | GENERAL |
| CR2.0 § 5.2.2/5.2.4 | 1.0 | Bewertung von EWS-Dossiers |
| CR § 1.0 / Appendix 8.1 §2.9 | 1.1 | Bewertung von Verträgen/SLA mit Critical/Non-Critical Locations |
| CR1.0 § 4.3.9 | 1.2 | Nichtbeachtung der internen Verfahren der ZertStelle |
| CR1.0 § 4.3.9 | 1.3 | Dokumente / QM-Systemdokumentation nicht aktuell |
| CR1.0 § 4.3.1 | 1.4 | Nichterfüllung der Akkreditierungsanforderung(en) |
| | | ZERTIFIZIERUNGSVERTRAG |
| CR2.0 § 5.1.3 / Appendix 2 | 2.0 | Kein Vertrag zwischen der ZertStelle und dem nach GMP+ zertifizierten Unternehmen |
| CR2.0 § 5.1.3 / Appendix 2 | 2.1 | Der Vertrag ist nicht mit der richtigen juristischen Person geschlossen worden |
| CR2.0 § 5.1.3 / Appendix 2 | 2.2 | Nichterfüllung im Rahmen des verpflichteten Mindestzeitaufwands |
| CR2.0 § 5.1.3 / Appendix 2 | 2.3 | Nichterfüllung im Rahmen einer Neuberechnung |
| CR2.0 § 5.1.3 / Appendix 2 | 2.4 | Die im GMP+ Feed Certification scheme genannten GMP+-Anforderungen sind im Vertrag nicht gesichert. |
| CR2.0 § 5.1.3 / Appendix 2 | 2.5 | Nichterfüllung im Rahmen der Vergabe an Unternehmen |
| CR1.0 § 4.3.2 | 2.6 | Nichterfüllung im Rahmen der Unparteilichkeit |
| CR1.0 § 4.2 / Appendix 8.1 und 8.4 | 2.7 | Nichterfüllung in Bezug auf Key Activities |
| CR2.0 § 5.1.3 / Appendix 2 | 2.8 | Nichterfüllung der Kriterien zur Berechnung des verpflichteten Mindestzeitaufwands |
| CR2.0 §5.1.2 | 2.9 | Nichterfüllung bei application review/pre-transfer review. |
| | | PLANUNG, GMP+-UNTERNEHMENSDATENBANK, ROTATION VON AUDITOREN |
| F0.1 § 4.4 | 3.0 | Die GMP+-Unternehmensdatenbank ist nicht ist aktuell |
| CR1.0 § 4.3.6.1 | 3.1 | Nichterfüllung im Rahmen der Auditoren-Zulassungsdokumentation |
| CR2.0 § 5.1.5.1 | 3.2 | Nichterfüllung im Rahmen der Rotationsanforderungen |
| CR1.0 § 4.3.6.1 | 3.3 | Nichterfüllung im Rahmen des Auditturnus |
| CR1.0 § 4.3.6.1 | 3.4 | Nichterfüllung im Rahmen des verpflichteten Mindestzeitaufwands für den internen Erfahrungsaustausch |
| CR2.0 § 5.2.1 | 3.5 | Nichterfüllung im Rahmen der Auditplanung |
| CR2.0 § 5.1.3 / Appendix 2 | 3.6 | Nichterfüllung im Rahmen der Reduzierung des Auditzeitaufwands |
| CR1.0 § 4.3.6.1 | 3.7 | Nichterfüllung im Rahmen der Auditor-Zulassung |
| CR2.0 § 5.1.4 und 5.1.6 | 3.8 | Nichterfüllung Audit-Programm/-Plan |
| | | ZERTIFIZIERUNG/BERICHTSPRÜFUNG |
| CR2.0 § 5.2.4 / Appendix 1 | 4.0 | Fehlerhafte Einstufung der Non-conformity |
| CR2.0 § 5.1 und 5.2 | 4.1 | Fehlerhaftes Zertifizierungsverfahren |
| CR2.0 § 5.1.2 und 5.2.7 | 4.2 | Nichterfüllung im Rahmen des Berichtsprüfungsverfahrens |
| CR2.0 § 5.2.1 | 4.3 | Nichterfüllung im Rahmen der Audithäufigkeit |
| CR2.0 § 5.2.8 und 5.2.9.3 | 4.4 | Nichterfüllung im Rahmen der Zertifizierungsentscheidung. |
| | | GMP+-ZERTIFIKATE / BEFRISTETE ZULASSUNG |
| CR2.0 § 5.2.9 / CR3.0 § 4.2.8 | 5.0 | Nichterfüllung im Rahmen von ausgestellten Zertifikaten / befristeten Zulassungen. |
| | | BEWERTUNG UND BERICHTERSTATTUNG |
| CR2.0 § 5.2.6 / CR3.0 § 4.2.5 (C6 § 2.9) | 6.1 | Nichterfüllung im Rahmen von Berichten |
| CR2.0 § 5.2.6 / CR3.0 § 4.2.5 (C6 § 2.9) | 6.2 | Nichterfüllung im Rahmen der Erledigung der Berichterstattung an den Teilnehmer |
| | | PARALLEL- UND WITHNESS AUDITS |
| CR2.0 §. 5.1, 5.2 und 5.4 / CR3.0 §. 4.1, 4.2 and 4.4 | 8.1 | Nichterfüllung im Rahmen der Planung des Audits. |
| CR2.0 § 5.2 / CR3.0 § 4.2 | 8.2 | Nichterfüllung im Rahmen der Durchführung des Audits. |
| CR2.0 §. 5.2 / CR3.0 §. 4.2 | 8.3 | Nichterfüllung im Rahmen des Berichts zum Audit. |
Appendix 4.3 Referenzdokument zur Beschreibung von Feststellungen während Parallel-Audits bei nach GMP+ zertifizierten Unternehmen
| Ref.-Nr. | Feststellungen während Parallel-Audits |
| 11.0 | Nichterfüllung im Rahmen des Kontextes des nach GMP+ zertifizierten Unternehmens R1.0; 4.1, 4.2, 4.3, 4.4 |
| 11.11 | Nichterfüllung im Rahmen der Country Note Antibiotikafreie Futtermittel TS2. 2; 2.0, 4.0 |
| 11.12 | Nichterfüllung im Rahmen der Country Note QM-Milch TS2.3; 2.0, 4.0, 5.0 |
| 11.13 | Nichterfüllung im Rahmen der Einführung TS3.1; 1.1, 1.3 |
| 11.14 | Nichterfüllung im Rahmen der Anforderungen des HACCP-Systems TS3.1; 3.1, 3.2, 3.3 |
| 11.15 | Nichterfüllung im Rahmen des Präventivprogramms TS3.1; 4.1, 4.2, 4.3, 4.4, 4.5 |
| 11.16 | Nichterfüllung im Rahmen der Prozesslenkung TS3.1; 5.1, 5.2, 5.3, 5.4, 5.5 |
| 11.17 | Nichterfüllung im Rahmen der Einführung TS3.2; 0.1 |
| 11.18 | Nichterfüllung im Rahmen des Sicherheitsmanagementsystems für Heimtierfuttermittel TS3.2; 1.1, 1.2 |
| 11.19 | Nichterfüllung im Rahmen der Präventivprogramme TS3.2; 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10, 2.11 |
| 11.20 | Nichterfüllung im Rahmen des HACCP-Systems TS3.2; 3.1, 3.2, 3.3 |
| 11.21 | Nichterfüllung im Rahmen der Systembedingungen R5.0; 4.1, 4.2, 4.3, 4.4, 4.5, 4.6 |
| 11.22 | Nichterfüllung im Rahmen der Lieferkettenmodelle R5.0; 5.1, 5.2, 5.3, 5.4, 5.5 |
| 11.23 | Nichterfüllung im Rahmen der Herstellung von und des Handels mit RTRS-Soja MI5.1; 4.1, 4.2, 4.3, 4.4 |
| 11.24 | Nichterfüllung im Rahmen von nachhaltigem Schweine- & Geflügelfutter MI5.2; 4.1, 4.2 |
| 11.25 | Nichterfüllung im Rahmen von nachhaltigem Milchviehfutter MI5.3; 4.1, 4.2 |
| 11.26 | Nichterfüllung im Rahmen von „GMO controlled“ MI5.4; 4.1, 4.2, 4.3, 4.4, 4.5, 4.6 |
| 11.27 | Nichterfüllung im Rahmen der Lieferkettenmodelle MI5.4; 5.1 |
| 11.28 | Nichterfüllung im Rahmen der Probenahme und Testung MI5.4; 6.1, 6.2, 6.3 |
| 11.29 | Nichterfüllung im Rahmen der Systembedingungen MI5.5; 4.0 |
| 11.30 | Nichterfüllung im Rahmen der Eingabe für die CFP-Berechnungen MI5.5; 5.1, 5.2, 5.3, 5.4 |
| 11.31 | Nichterfüllung im Rahmen der Berechnung des CFP für Futtermittel MI5.5; 6.1, 6.2, 6.3, 6.4, 6.5 |
| 11.32 | Nichterfüllung im Rahmen der Zusatzberechnung der Emissionsfaktoren für die Methan-Produktion von Futtermitteln MI5.5; 7.0 |
| 11.33 | Nichterfüllung im Rahmen der Kompensierung des CPF-LUC-Indikators MI5.5; 8.0 |
| 11.34 | Nichterfüllung im Rahmen der Unterrichtung des Kunden MI5.5; 9.0 |
| 11.35 | Nichterfüllung im Rahmen der Herstellung von und des Handels mit nachhaltigen Futtermitteln MI5.6; 4.1, 4.2 |
| 11.36 | Nichterfüllung im Rahmen der Verwendung von GMP+ FC Logos / Markenzeichen F01; 6.0 |
| 11.37 | Nichterfüllung im Rahmen des Transports von Futtermitteln per Küsten- und Binnenschifffahrt TS3.3; 1a-b, 1.5, 2, 3, 4.2, 5a-b-c, 6, 7, 8, 9a-b-c, 10, 11, 12, 13, 14, 15, 16, Anhang 1 |
| 11.38 | Nichterfüllung im Rahmen von Laboruntersuchungen TS4.1; 2.0, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0, 11.0, 12.0, 13.0, 14.0 |
| 11.39 | Nichterfüllung im Rahmen von Registrierten Laboren TS4.2; 2.0, 3.0, 4.0, 5.0 |
Appendix 5: Verantwortlichkeiten zur Verarbeitung von Daten in der GMP+-Datenbank und/oder in Bezug auf das Veröffentlichungsrecht
| Verantwortlich für: | Paragraph | GMP+ Int. | ZertStelle/ Critical Location |
| Veröffentlichung von Zertifizierungs Stelle/Critical Location | 4.2.5 | X | - |
| Veröffentlichung einer suspendierten ZertStelle/Critical Location | 5.5 | X | - |
| Veröffentlichung der Beendigung des GMP+ Feed Certification scheme License Agreement | 5.5 | X | - |
| Veröffentlichung der Nichtverlängerung des GMP+ Feed Certification scheme License Agreement durch GMP+ International | 5.5 | X | - |
| Veröffentlichung der Tatsache, dass eine andere ZertStelle die Verpflichtungen übernimmt, wenn die ursprüngliche ZertStelle suspendiert ist. | 5.5 | X | - |
| Informierung der betreffenden nach GMP+ zertifizierten Unternehmen, sofern die Akzeptierung einer ZertStelle entzogen bzw. nicht verlängert wurde. | 5.5 | X | - |
| Veröffentlichung eines suspendierten Unternehmens | 5.3 (CR2.0) | X | - |
| Veröffentlichung der Entziehung eines GMP+-Zertifikats eines Unternehmens wegen Nichterfüllung | 5.3 (CR2.0) | X | - |
| Verantwortlich für: | Paragraph | GMP+ Int. | ZertStelle/ Critical Location |
| die Verarbeitung von Daten eines nach GMP+ zertifizierten Unternehmens (Besucheradresse), die im öffentlichen Bereich des GMP+-Portals veröffentlicht werden. | |||
| Offizieller Name des GMP+ zertifizierten Unternehmens | 4.3.7.1. | - | X |
| Straße | 4.3.7.1. | - | X |
| Hausnummer | 4.3.7.1. | - | X |
| Postleitzahl | 4.3.7.1. | - | X |
| Ort | 4.3.7.1. | - | X |
| Land | 4.3.7.1. | - | X |
| Gesetzliche Registriernummer des Unternehmens / IHK-Nummer | 4.3.7.1. | - | X |
| Telefonnummer | 4.3.7.1. | - | X |
| E-Mail-Adresse | 4.3.7.1. | - | X |
| Website | 4.3.7.1. | - | X |
| Name des Schiffes | 4.3.7.1. | - | X |
| EU-Nummer | 4.3.7.1. | - | X |
| die Verarbeitung von Daten eines nach GMP+ zertifizierten Unternehmens (Postanschrift), die im öffentlichen Bereich des GMP+-Portals veröffentlicht werden. | |||
| Postfachnummer | 4.3.7.1. | - | X |
| Postleitzahl | 4.3.7.1. | - | X |
| Ort | 4.3.7.1. | - | X |
| Land | 4.3.7.1. | - | X |
| die Verarbeitung der Zertifizierungsdaten eines nach GMP+ zertifizierten Unternehmens, die teilweise im öffentlichen Bereich des GMP+-Portals veröffentlicht werden. | |||
| Anwendungsbereich(e) | | - | X |
| Zertifiziert seit | | - | X |
| Anfangsdatum des Zertifikats | | - | X |
| Enddatum | | - | X |
| Datum der Suspendierung (sofern zutreffend) | | - | X |
| Datum der Entziehung (sofern zutreffend) | | - | X |
| Grund der Suspendierung (sofern zutreffend) | | - | X |
| Datum der aufgehobenen Suspendierung | | | X |
| Grund der Entziehung (sofern zutreffend) | | - | X |
| Zertifizierungsstatus | | - | X |
| Reduzierung des Auditzeitaufwands | | - | X |
| Verantwortlich für: | Paragraph | GMP+ Int. | ZertStelle/ Critical Location |
| die Verarbeitung der Zertifizierungsdaten eines nach GMP+ zertifizierten Unternehmens, die teilweise im öffentlichen Bereich des GMP+-Portals veröffentlicht werden. | |||
| Kopplung/Entkopplung eines Matrixzertifizierungsstandorts / Zugmaschinen mit Fahrer an den/vom Hauptstandort / Auftraggeber | | X | - |
| Kontaktperson beim nach GMP+ zertifizierten Unternehmen | | - | X |
| Telefonnummer für Notfälle (24 Stunden täglich, 7 Tage pro Woche) | | - | X |
Appendix 6: GMP+ Feed Certification scheme License Agreement
Der vorliegende Appendix enthält das Muster für den Lizenzvertrag, der von GMP+ International für den Abschluss des Lizenzvertrags für das GMP+ Feed Certification scheme License Agreement mit jeder Zertifizierungsstelle gemäß von Artikel 3 von F0.1 Rechte und Pflichten verwendet.
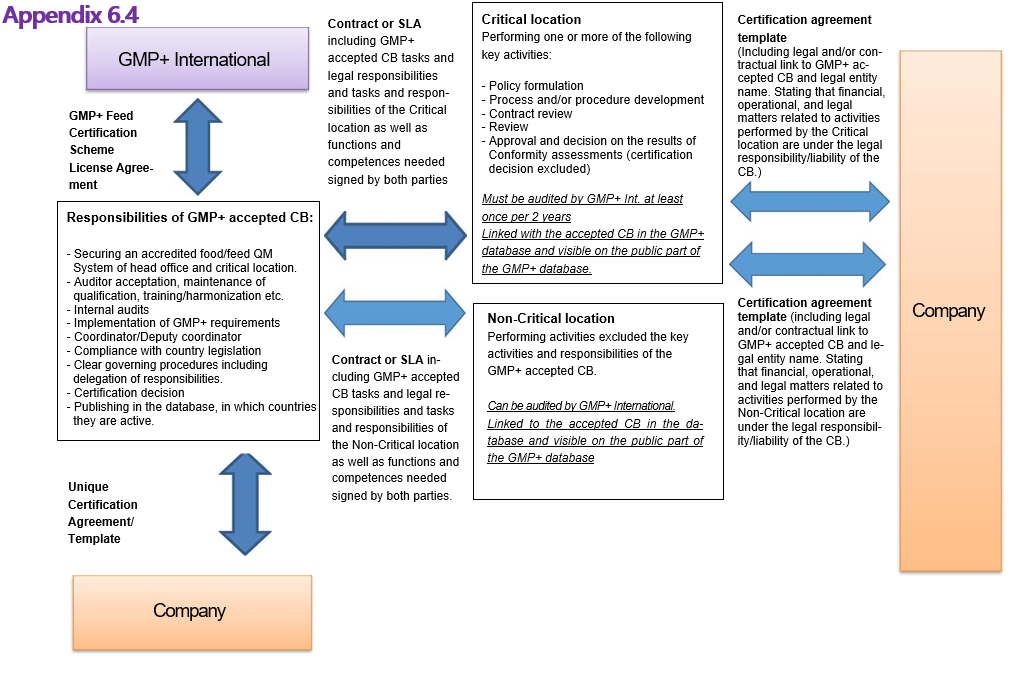
Dieses Dokument hat den Zweck, allen Parteien, die am GMP+ Feed Certification scheme beteiligt sind, (gemäß der Visualisierung in Appendix 6.4 dieses Dokuments) einen gesetzlichen Rahmen zu bieten. Zur Gewährleistung der Transparenz in Richtung aller beteiligten Parteien wurden folgende Hauptziele festgelegt:
- das Zustandebringen eines Vertragsverhältnisses, beginnend bei GMP+ International bis einschließlich des GMP+-zertifizierten Unternehmens.
- ein Compliance-Assessment gegenüber die Zertifizierungsstellen kann ausschließlich von GMP+ International Auditoren durchgeführt werden.
Um dies fest zu stellen, wurden die in diesem Dokument enthaltenen Kriterien möglichst weitgehend auf der Grundlage internationaler Standards erstellt und beinhalten den GMP+ Anforderungen.
Appendix 6.1: Model agreement
The following text must be used for the GMP+ Feed Certification scheme License agreement (hereafter License Agreement) between GMP+ International and an accepted Certification Body.
Beginning (model) agreement:
__________________________________________________________________________________________
The undersigned:
- The Dutch law limited liability company GMP+ International BV, with its registered office at the Braillelaan 9 in (2289 CL) Rijswijk (The Netherlands), registered at the Trade Register of the Dutch Chamber of Commerce under number 27364542,
(hereinafter: “GMP+ International”),
und
- [Name of the certification body], with its registered office at the [address, including country], registered at the [official name of local trade register where the entity is registered] under number [ ],
(hereinafter: “Certification Body”),
(hereinafter collectively referred to as “the Parties”)
Whereas:
- GMP+ International is the holder of rights to the GMP+ Feed Certification scheme, an international certification scheme covering the whole feed chain, consisting of the GMP+ Feed Safety Assurance Module for the assurance of feed safety and the GMP+ Feed Responsibility Assurance Module for the assurance of feed responsibility.
- The GMP+ Feed Safety Assurance Module integrates a variety of feed safety requirements into one module, such as requirements for the feed safety management system, HACCP, product standards, traceability, monitoring, prerequisites programs, chain approach and the Early Warning System. The GMP+ Feed Responsibility Assurance Module incorporates requirements for production, trade, storage & transshipment and transport of feed products with respect for humans, animals and the environment;
- GMP+ International holds rights to the Licensed IP, (definitions are described in Article 1 below);
- The certification of the GMP+ Feed Certification scheme is not performed by GMP+ International but by licensed Certification Bodies. Companies wishing to obtain GMP+ Feed Certification scheme certification directly approach such a licensed certification body;
- The Certification Body is involved in the certification and is interested in obtaining a License Agreement to perform certification according GMP+ Feed Certification scheme and using the Trademarks, Logos and Documentation;
- GMP+ International is interested in granting the Certification Body a License Agreement, with the aim to allow the Certification Body to certify companies complying with the scope(s) of the GMP+ Feed Certification scheme.
Now it is agreed between the Parties as follows:
- Defi nitions
For the purpose of this Agreement, the definitions in the GMP+ Feed Certification scheme are applicable. See F0.2 Definition list, the Feed Safety Assurance module and the Feed Responsibility Assurance module.
In addition or notwithstanding, the following terms and definitions shall have the meaning within the framework of this Agreement as set forth below:
1.1 Appendix(es): the Appendixes attached to this agreement which form an integral part of this agreement and have been separately initialed by the Parties and in which the agreements between the Parties have been detailed.
1.2 Basic payment: an annual payment, consisting of two components: a) a basic tariff and use of database web application and API, and b) a variable payment depending on the number of scope(s) and kind of activities of the Certification Body and if applicable, Critical Location and the GMP+ Certified Companies certified by the Certification Body.
1.3 Critical Location: a location of Certification Body conducting one or more key activities (for definition key activities see Chapter 3 of F0.2 Definition list)
1.4 Documentation: any documentation provided to the Certification Body by GMP+ International during the term of the License Agreement, including but not limited to the documents of the GMP+ Feed Certification scheme.
1.5 GMP+ Certified Company Emergency Telephone Number: a telephone number of the GMP+ certified company which can be reached 24/7 and 365 days of the year in case of emergencies.
1.6 GMP+ Company Database: a publicly accessible database administered by GMP+ International and actualized by GMP+ International, Certification Bodies and/or Critical Location containing details of the Certification Bodies, Critical Locations and GMP+ Certified Companies .(See Appendix 5 of this document)
1.7 Licensed IP: Trademarks, Logos and the Documentation.
1.8 Logos: any logo of GMP+ International that is protected or not by a trademark in the countries of activity of the users. See chapter 5 of F0.1 Rights and Obligations
1.9 Measure(s): has the meaning as defined in Article 5.5 of this document.
1.10 Non-Critical Location; a location of a Certification Body conducting no key-activities. See chapter 3 of F0.2 Definition list.
1.11 Sanction(s): has the meaning defined in Article 5.5 of this document.
1.12 Suspension: the Certification Body is temporarily suspended for a maximum period of 3 months, if GMP+ International rules that the Certification Body’s is in breach of this License Agreement and therefore denied the rights arising from this License Agreement. This suspension automatically results that Critical Location and, Non-Critical Location not being allowed to conduct any GMP+ activities for the same period. All remaining requirements and obligations are stated in Article 5.5 of this document.
1.13 Termination: To terminate the License Agreement under the conditions as set out in GMP+ Feed Certification scheme.
1.14 Trademarks: the trademarks licensed to GMP+ International, listed in Appendix 1.6 of this document.
1.15 Website: GMP+ International’s website www.gmpplus.org.
- The GMP+ Feed Certification scheme
2.1 Upon signing of this License Agreement, the Certification Body guarantees that it implements and complies with all applicable requirements in the GMP+ Feed Certification scheme. Parties agree that the most recent version of the GMP+ Feed Certification scheme is integral part of this License Agreement.
2.2 The most recent version of the GMP+ Feed Certification scheme is publicly accessible at the Website www.gmpplus.org of GMP+ International. Upon request of the Certification Body, GMP+ International shall promptly provide the Certification Body with a free copy of the most recent version of the GMP+ Feed Certification scheme, electronically or otherwise. By signing this License Agreement, the Certification Body expressly agrees to the above ways to take note of the GMP+ Feed Certification scheme and declares that prior to signing this License Agreement it has read and understood these documents.
2.3 GMP+ International may at any time amend the GMP+ Feed Certification scheme. GMP+ International shall promptly, electronically or otherwise, notify the Certification Body of amendments to the GMP+ Feed Certification scheme. The certification body must comply with the amendments of the requirements within a period, as mentioned in the S9.1 List of changes GMP+ FC scheme 2020, unless GMP+ International determines a shorter period.
2.4 Upon signing of this License Agreement the Certification Body and its Critical Location(s) must have the required accreditation. See article 4.3.1. of this document.
2.5 The Certification Body must provide full cooperation to GMP+ International in the accurate implementation of the GMP+ Feed Certification scheme.
2.6 GMP+ International is allowed to conduct Compliance Assessments and/or Compliance Audits at the premises of the Certification Body and its, Critical-, Non-Critical Location(s) as well as at the GMP+ Certified Companies. The Certification Body and its Critical Location(s) must lend its full cooperation to such Compliance Assessments. See article 5 of this document.
2.7 GMP+ International shall, as far as reasonably possible, enable the Certification Body to give advice with respect to proposed changes to the GMP+ Feed Certification scheme via its public consultation procedure and the GMP+ Subcommittee Certification & Compliance.
2.8 The Certification Body has the right to nominate candidates to represent all Certification Bodies for membership of the GMP+ Subcommittee Certification & Compliance.
2.9 The Certification Body can only delegate key activities to Critical Location(s) and non-key activities to Non-Critical Location(s) by means of a Contract or a Service Level Agreement (SLA).
2.10 The Certification Body shall keep proper records of Contracts and/or SLA established between the Critical/Non-Critical Location(s) and shall have these records readily available for assessment by GMP+ International during a Compliance Assessment.
2.11 The Certification Body must inform GMP+ International immediately in case a Critical/Non-Critical Location is in breach of the Contract and/or SLA.
- Grant of license
3.1 Subject to the terms and conditions of the License Agreement, GMP+ International grants and the Certification Body accepts, a non-exclusive license to certify companies complying with the scope(s) of the GMP+ Feed Certification scheme.
3.2 Subject to the terms of the License Agreement, GMP+ International allows the Certification Body to use the GMP+ Logo/Trademarks as further set out in F0.1 Rights and Obligations. The right to use the GMP+ Logo/Trademarks can exclusively be granted by GMP+ International. The right to use the GMP+ Logo/Trademark can be withdrawn if the Certification Body does not comply with the requirements as set out in the GMP+ Feed Certification scheme and fails to remedy the same within the determined timeframe.
3.3 The Documentation shall not be published nor modified in any way by the Certification Body. The Certification Body has the right to reproduce the Documentation for its own use or, subject to the conditions of the License Agreement, to make it available to the GMP+ Certified Companies.
3.4 The Certification Body has the duty to immediately report to GMP+ International any infringement of the Licensed IP which comes to the notice of the Certification Body.
3.5 GMP+ International shall always have the right to sue in respect of infringement of the Licensed IP without the Certification Body, at its own expense and under its sole liability, and to earn exclusively the results of the proceedings.
3.6 The Certification Body must perform and document its internal audits (at the Critical Location) to be conducted every 12 months.
3.7 The Certification Body is responsible to comply with the applicable country legislation were the Certification Body is located.
3.8 The Certification Body is responsible for:
- the certification decision;
- auditor acceptation, maintenance of qualification, training etc.;
- clear governing procedure including delegation of responsibilities;
- have a GMP+ coordinator/ deputy connected to the location and the certification body.
- Certification and auditing of Companies
4.1 The Certification Body shall conclude a unique Certification Agreement and/or Certification agreement template with a Company before conducting an Initial (Certification) Audit. During the validity of a GMP+ certificate, the Certification Body must conduct audits at the GMP+ Certified Companies in accordance with the GMP+ Feed Certification scheme.
4.2 After the decision of the Certification Body, the Certification Body/Critical Location shall have the right to issue Certificates to Companies for the scopes specified in Appendix 6.3.
4.3 The Critical/Non-Critical Locations may offer GMP+ International’s activities to the local market only on behalf of the Certification Body which must always mention the name and logo of the Certification Body.
4.3.1 In the standardized certification agreement signed on behalf of the Certification Body in the form of a template approved by the Certification Body, between the Critical/Non-Critical location and the Company a legal or contractual link to the Certification Body and legal entity name must be included, stating the financial-, operational- and legal matter related to activities performed by the Critical/Non-Critical location are under the liability of the Certification Body.
4.3.2 The reports issued to the GMP+ Certified Companies shall contain the name and address of the GMP+ International accepted Certification Body without the logo of the Critical and/or Non-Critical Location. However the report may make reference to the contact details of the Critical and/or Non-Critical Location issuing the report in question.
4.4 The certificate issued to the GMP+ Certified Company shall contain the name and address of the Certification Body without the logo of the Critical Location. However the certificate may make reference to the contact details of the Critical Location issuing the certificate in question. The certificate issued shall not create any confusion as to the Certification body.
4.5 The Certification Body, Critical/Non-Critical Location is obliged to keep proper records of unique- and/or standardized Certification Agreement in the form of a template approved by the Certification Body, and results and reports of the Audits at GMP+ Certified Companies and the certificate and is obliged to have these records readily available in the global quality management system for Compliance assessment by GMP+ International. In case GMP+ International wants to receive (copies of) records, the Certification Body, Critical/Non-Critical Location is obliged to make the requested information available to GMP+ International accordingly.
4.6 The Certification Body must inform GMP+ International immediately in case a Participant is in breach of the Certification Agreement with respect to conditions and obligations arising from the GMP+ Feed Certification scheme.
4.7 GMP+ International has the right, at any time, to conduct a Compliance Audit of the GMP+ Certified Company or to participate as witness during an Audit. The cost of these audits is at the expense of GMP+ International.
- Confidentiality
5.1 The Certification Body must not disclose to third parties any Documentation, or use it for any purpose other than as described herein, unless GMP+ International agrees otherwise prior to disclosure in writing.
5.2 Non-disclosure obligations arising from Article 5.1 shall not apply to Documentation the contents of which have become generally known or easily accessible or which have been lawfully revealed by a third party. In case to comply with law and/or legal regulation and/or by orders of a court, governmental agency but always with prior notice to GMP+ International.
5.3 The Certification Body must procure that all of its employees and Critical/Non-Critical Location and their employees, if any, adhere to the obligations arising out of Article 5.1.
5.4 With exception of the cases of authorization mentioned in the GMP+ Feed Certification scheme, GMP+ International shall not disclose to third parties any information of the Certification Body and will not use it for any purpose other than as described herein, unless the Certification Body agrees otherwise prior to disclosure in writing.
- Fees
6.1 Every year, the Certification Body must pay to GMP+ International the Basic payment. The amounts hereof are specified in the CR4.0 Tariffs of the GMP+ Feed Certification scheme. The amounts specified therein are agreed net. If VAT is applicable, this shall be borne by the Certification Body. Any local and/or other taxes, governmental fees or dues, if applicable, shall also be borne by the Certification Body.
Every year, the Critical Location must pay to GMP+ International a fixed fee as establish in article 2.2 of the CR4.0 Tariffs.
6.2 The Basic Payment is determined by GMP+ International. GMP+ International reserves the right to unilaterally adjust the amounts in the CR4.0 Tariffs of the GMP+ Feed Certification scheme.
6.3 The Certification Body/Critical Location must keep the GMP+ company database up to date as mentioned in Appendix 5 of this document in order to enable GMP+ International to extract the necessary information required to calculate the Basic payment.
6.4 In addition to the Basic payment, the Certification Body hereby agrees to pay GMP+ International a fee for the examination by GMP+ International of its auditors. The amounts hereof are specified in the CR4.0 Tariffs of the GMP+ Feed Certification scheme.
The amounts specified therein are agreed net. If VAT is applicable, this shall be borne by the Certification Body. Any local and/or other taxes, governmental fees or dues, if applicable, shall also be borne by the Certification Body.
- GMP+ Company Database
7.1 The Certification Body must comply with the (applicable) requirements and obligations as stated in article 4.3.7.1 of this document which is an integral part of this agreement.
- Default
8.1 In the event the Certification Body, Critical/Non-Critical Location is not or not fully performing one or more of the obligations arising from this Agreement, including but not limited to obligations arising from the GMP+ Feed Certification scheme measures and sanctions as stated in 5.5 of this document, which is an integral part of this agreement,will be imposed.
- Conditions for the GMP+ accepted Certification Body operating with Critical and Non-Critical Location(s).
9.1 The Certification Body and its Critical and Non-Critical location must operate under the same management and the same digital global quality management system accessible of all locations.
9.2 The Certification Body shall have the means to substantially influence and control the activities of the locations. The Certification Body shall be able to demonstrate that such influence and control is in place and properly working.
9.3 The Certification Body maintains the final responsibility for the GMP+ International activities performed by the Critical, Non-Critical location.
9.4 Where the Critical location(s) carry out key activities then the GMP+ International accepted Certification Body shall in its contract and/or SLA clearly identify the address of these locations.
9.5 The use of Critical and/or Non-Critical locations is only allowed for locations within the same organization and where the Certification Body maintains the legal responsibility for the activities performed and certificates/reports issued by the Critical and/or Non-Critical locations.
The legal responsibility must be demonstrated on the basis of contract/SLA or equivalent legal relationships between the Certification Body and the Critical and/or Non-Critical locations and internal regulations in the organization that further specify these relationships in terms of management and legal responsibilities.
9.6 Using Critical and/or Non-Critical locations is possible for all types of local locations such as subsidiaries, branches, agencies, offices, etc. regardless of their legal personality, as long as they carry out clearly defined and relevant activities within the scope(s) of the GMP+ Feed Certification scheme.
9.7 Holding the final responsibility as mentioned in article 9.4 for activities performed by the Critical and/or Non-Critical location, implies that the Certification body takes the operational, financial and legal responsibility/liability for activities performed by these locations, and this operational, financial and legal responsibility/liability must be stated in the GMP+ certification agreement with its customers.
- Duration and termination
10.1 This Agreement will enter into force on the dd.mm.yyyy if signed by the Parties and will remain in force until dd.mm.yyyy.
10.2 GMP+ International is entitled to terminate this Agreement with immediate effect by written notice to the Certification Body if:
- the Certification Body does not comply with the binding instructions issued by GMP+ International as stated in Article 2.4f of F0.1 Rights and Obligations.
- the Certification Body has no accredited food/feed quality management system.
- the Certification Body does not or not fully perform one or more of the essential of its obligations arising from the GMP+ Feed Certification scheme.
10.3 Either Party may terminate or not to renew this Agreement with immediate effect by written notice to the other Party if:
- either Party commits any breach of any of the provisions of this Agreement and, in the case of a breach capable of remedy, fails to remedy the same within a determined timeframe after receipt of an official letter giving full particulars of the breach and require corrective actions;
- an encumbrance takes possession or a receiver is appointed over any of the property or assets of that other Party or is declared bankrupt;
- that other Party makes any voluntary arrangement with its creditors or becomes subject to an administration order;
- that other Party goes into liquidation;
- anything which, under the law of any jurisdiction, is analogous to any of the acts or events specified in clauses 10.3 a)-d) of this Agreement; or
- that other Party ceases, or threatens to cease, to carry on business.
10.4 In the event that a Certification Body terminates or not to renew the License Agreement they are obliged to inform all parties concerned three months in advance to enable all GMP+ Certified Companies to transfer to another Certification Body.
- Liability
11.1 The Certification Body shall reimburse GMP+ International for the principal amount of a claim for compensation or damages by a GMP+ Certified Companies and/or a Company directed at GMP+ International insofar as GMP+ International’s liability towards the GMP+ Certified Companies and/or the Company is related to the performance of the Certification Agreement by the Certification Body and subsequently its Critical/Non-Critical Location and on the condition that such liability has been established by a final court judgment or final arbitral award.
11.2 The indemnity as set out in Article 11.1 does not apply if:
- A claim directed at GMP+ International is based on acts of GMP+ International itself (including but not limited to use of the binding instruction, a violation by GMP+ International of the GMP+ scheme or external communication by GMP+ International)
- Or the claim is based on such facts or circumstances as the Certification Body and subsequently its Critical/Non-Critical Location did not know or could not have been expected to know and taken into account at the time of the performance of the Certification Agreement.
11.3 The indemnity as set out in Article 11.1 applies nonetheless if an act of GMP+ International as set out in Article 11.2 is due to GMP+ International having based its conduct on incorrect information provided by the Certification Body and/or Critical/Non-Critical Location (and the Certification Body and/or Critical/Non-Critical Location knew or should have known that it was incorrect).
11.4 In case of a claim within the scope of this Article 11, GMP+ International shall forthwith fully inform the Certification Body and not enter into an amicable settlement with claimant without prior written consent of the Certification Body, on penalty of forfeiture of the rights under this Article 11.
11.5 The Certification Body shall at all times be fully liable towards GMP+ International for all acts and omissions by its Critical/Non-Critical Location.
11.6 The liability of parties towards each other in connection with performance of this Agreement and this Article 11 is at all times limited to € 250,000 per claim with a maximum of € 1,000,000 per calendar year.
- Miscellaneous
12.1 This Agreement constitutes the complete and full agreement between the Parties and includes Appendix 6.2, 6.3 and 6.4.
12.2 Any invalidity of individual provisions of this Agreement shall not affect the validity of the remaining provisions of this Agreement. The remaining provisions of this Agreement shall remain in full force and effect and enforceable to the fullest extent permitted by law. Any provisions found to be invalid or unenforceable shall be substituted by such other provisions coming, in a legally permissible way, as close as possible to the economic meaning and intention of such invalid provision.
12.3 The Certification Body is not allowed to assign this Agreement in whole or in part or any benefit or interest therein.
- Applicable law and disputes
13.1 This Agreement shall be governed by and construed in accordance with the laws of The Netherlands.
13.2 All disputes arising in connection with the Agreement, or further contracts resulting therefrom, shall be heard by the District Court of Rotterdam, having exclusive jurisdiction.
Drawn up and signed in duplicate,
| GMP+ International BV | [Name Certification Body] |
| Managing Director | [Name of legal representative] (Title of legal representative) |
| …………………………… (Signature) | …………………………… (Signature) |
| Place: Rijswijk | Place: ....................................... |
| Date: ……………………… | Date: ……………………… |
Appendix 6.2: Trademarks and Logo’s
Trademarks and applicable logo(s) will be added in individual Agreement(s)
The trademarks have been protected globally. For instance, GMP+ International is the owner of the following registrations:
GMP+ FSA word mark: Benelux, EU and international registrations
GMP+ FSA logo: Benelux, EU, UK and international registrations
GMP+ FRA logo: EU and UK registrations
A complete overview of the list will be shared upon request.
Appendix 6.3: Scopes covered by the GMP+ Feed Certification scheme (License) Agreement
This document is part of the GMP+ Feed Certification scheme License Agreement which has been entered into force <date><month><year> for the period until <date><month><year> between GMP+ International and
| Name of the Certification Body: | |
| Address: | |
| Location : | |
The GMP+ Feed Certification License Agreement will relate to the following scopes of the GMP+ Feed Certification scheme with effect from the date specified below:
| GMP+ scopes | Accepted / |
| Production of compound feed | |
| Production of compound feed | |
| Production of compound feed – petfood | |
| Production of premixtures | |
| Production of premixtures | |
| Production of feed additives | |
| Production of feed additives | |
| Production of feed materials | |
| Production of feed materials | |
| Production of feed materials – petfood | |
| Trade | |
| Trade in feed | |
| Trade in feed – petfood | |
| Trade to livestock farms | |
| Storage and Transshipment | |
| Storage and Transshipment of feed | |
| Transport | |
| Road transport of feed | |
| Rail transport of feed | |
| Inland waterway transport and short sea shipping of feed | |
| Affreightment | |
| Affreightment of short sea shipping | |
| Affreightment of inland waterway transport | |
| Affreightment of sea transport | |
| Affreightment of rail transport | |
| Affreightment of road transport | |
| Laboratories | |
| Laboratory testing | |
| Registered laboratory | |
| Additional scopes | |
| Antibiotics-free production site | |
| Dioxin-monitoring in feed for laying hens | |
| QM-Milch | |
| FRA scopes | |
| RTRS | |
| Responsible dairy feed | |
| Responsible Pig & Poultry feed | |
| Production of compound feed – GMO controlled | |
| Production of premixtures – GMO controlled | |
| Production of feed additives – GMO controlled | |
| Production of feed materials – GMO controlled | |
| Trade in feed – GMO controlled | |
| Storage and Transshipment of feed – GMO controlled | |
| Road transport of feed – GMO controlled | |
| Carbon footprint of feed | |
| Responsible feed | |
Valid from: <date of signature>
Valid until: <date><month><year>
| GMP+ International BV | [Name Certification Body] |
| Managing Director | [Name of legal representative] (Title of legal representative) |
| …………………………… (Signature) | …………………………… (Signature) |
| Place: Rijswijk | Place: ....................................... |
| Date: ……………………… | Date: ……………………… |
Appendix 6.4: Vertragliche Beziehungen