1. Anwendungsbereich dieses Dokuments
Dieses Dokument enthält die Bewertungs- und Zertifizierungskriterien zur Durchführung von Audits bei antragstellenden Organisationen/nach GMP+ zertifizierten Unternehmen, die zu einer (Re-)Zertifizierung gemäß dem Feed Safety Assurance (FSA)-Modul des GMP+ Feed Certification scheme führen.
2. Normative Verweisung(en)
Im vorliegenden Dokument wird auf die nachstehenden normativen (Teile von) Dokumente(n) verwiesen; ihre Befolgung ist obligatorisch. Im Falle von Referenzen mit Datumsangabe findet ausschließlich die zitierte Fassung Anwendung. Im Falle undatierter Referenzen gilt die letzte Fassung des Dokuments, auf das verwiesen wird (einschließlich etwaiger Änderungen).
- ISO/IEC 17021-1:2015 Konformitätsbewertung - Anforderungen an Stellen, die Managementsysteme auditieren und zertifizieren.
- ISO 22003-1:2022(E) Anforderungen an Stellen, die Managementsysteme für die Lebensmittelsicherheit auditieren und zertifizieren.
- IAF-Pflichtdokument für die Übertragung akkreditierter Zertifizierung von Managementsystemen - AF MD 2:2017
- IAF MD 5:2019 - Ermittlung von Auditzeiten für die Auditierung von Qualitätsmanagement- (QMS) und Umweltmanagementsystemen (UMS), sowie Managementsystemen für Sicherheit und Gesundheit bei der Arbeit (SGA-MS).
- ISO/IEC 17020:2012 Konformitätsbewertung – Anforderungen an den Betrieb verschiedener Typen von Stellen, die Inspektionen durchführen.
- ISO/IEC 17025:2017 Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien.
- F0.1 Rechte und Pflichten
- F0.2 Definitionsverzeichnis
- F0.3 Anwendungsbereiche für die Zertifizierung
- CR1.0 Akzeptierungsanforderungen
- CR3.0 Bewertung und Zertifizierung der Feed Responsibility Assurance.
- GMP+ Feed Safety Assurance-Modul 2020.
3. Begriffe und Definitionen
Zu den GMP+-Definitionen siehe F0.2 Definitionsverzeichnis. In diesem gesamten Dokument wird die Formulierung „über die Zertifizierungsstelle“ verwendet, um anzugeben, dass alle Tätigkeiten, die von Critical/Non-Critical Locations durchgeführt werden, in die Verantwortung/Haftung der von GMP+ akzeptierten Zertifizierungsstelle fallen.
4. Grundsätze
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 4 |
5. Verfahrensanforderungen
5.1. Aktivitäten im Vorfeld der Zertifizierung
5.1.1. Antrag
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.1.1 |
Darüber hinaus gelten die zutreffenden Angaben zur antragstellenden Organisation, die unter § 9.1.1. Buchstabe B) von ISO/IEC 17021-1:2015 aufgeführt sind:
- Torwächterprotokolle
- Matrixzertifizierung
- Zahl der Arbeitnehmer
- Zahl der Erzeugnisse.
- Eine aktualisierte Konzernstruktur der antragstellenden Organisation, einschließlich des endbegünstigten Eigentümers und einer Übersicht über die Geschäftsführung, sowie eine Erklärung, in der die antragstellende Organisation, der endbegünstigte Eigentümer oder die Beteiligung der Geschäftsführung an Unternehmen, die mit dem Unternehmen der antragstellenden Organisation vergleichbar sind, aufgeführt werden, um zu bestätigen, dass die antragstellende Organisation die Anforderungen in Abschnitt 5 von F0.1 Rechte und Pflichten erfüllt.
und sofern zutreffend:
- Anzahl Analysen
- akkreditierte Analysen
- teilweise akkreditierte Analysen
- nicht akkreditierte Analysen.
5.1.2. Bewertung des Antrags
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.1.2 |
Außerdem:
- Beschreibung von Tätigkeiten und/oder Verfahren, die während eines Audits von der Zertifizierungsstelle bewertet werden müssen.
- Der Anwendungsbereich der Zertifizierung darf nicht irreführend sein.
5.1.3. Zertifizierungsvertrag
Vor der Durchführung eines Zertifizierungsaudits bzw. einer Inspektion müssen die Zertifizierungsstelle und die antragstellende Organisation einen rechtsverbindlichen individuellen Zertifizierungsvertrag schließen. Solange das GMP+-Zertifikat/die befristete Zulassung gültig ist, gilt auch dieser rechtsverbindliche individuelle Zertifizierungsvertrag.
Ein Zertifizierungsvertrag, der von einer Critical/Non-Critical Location erstellt wird, muss dem von der jeweiligen Zertifizierungsstelle genehmigten Muster entsprechen.
Die Zertifizierungsstelle muss sich folgender Punkte bewusst sein:
- Der Zertifizierungsvertrag muss grundsätzlich mit der korrekten juristischen Person vereinbart werden.
- Diese Verträge müssen geschlossen werden, bevor die jeweiligen Zertifizierungstätigkeiten gemäß dem GMP+ Feed Certification scheme angegeben und beschrieben werden.
- Die Zertifizierungsstelle darf Tätigkeiten, Prozesse, Produkte und Dienstleistungen nicht vom Zertifizierungsanwendungsbereich ausschließen, wenn diese sich auf die Futtermittelsicherheit der Endprodukte gemäß der Definition im Zertifizierungsanwendungsbereich auswirken können.
- Es ist nicht gestattet, im Zertifizierungsvertrag Anforderungen festzulegen, die gegen die GMP+-Anforderungen verstoßen.
- Es ist nicht gestattet, an die antragstellende Organisation bzw. das nach GMP+ zertifizierte Unternehmen andere Anforderungen zu stellen und festzulegen, die über die Anforderungen hinausgehen, die im GMP+ Feed Certification scheme festgelegt sind, es sei denn, dies ist im internen Verfahren der nach GMP+ zertifizierten Unternehmen festgelegt.
Die folgenden GMP+-spezifischen Anforderungen müssen im Zertifizierungsvertrag festgelegt werden:
- der oder die geltenden Anwendungsbereiche/Module, die mit der GMP+-Zertifizierung übereinstimmen
- der verpflichtete Mindestauditzeitaufwand pro Anwendungsbereich(e)/Modul pro Audittyp wie in Appendix 2 angegeben; Verweise auf Appendix 2 reichen nicht aus. Es ist nicht gestattet, mithilfe einer Inrechnungstellung auf der Grundlage einer Neuberechnung von diesem verbindlichen Auditzeitaufwand abzuweichen. Wenn ein längerer Auditzeitaufwand gilt, kann dies nach Rücksprache mit der antragstellenden Organisation bzw. dem nach GMP+ zertifizierten Unternehmen umgesetzt werden. Für eine Matrixzertifizierung gilt der verpflichtete Mindestzeitaufwand, der in Appendix 4 angegeben ist.
- Jeder Matrixzertifizierungsstandort muss mit der korrekten GMP+-Registriernummer erfasst sein, zudem muss der anwendbare verpflichtete Auditzeitaufwand je Audittyp gemäß Appendix 4 festgelegt werden, ein Verweis auf Appendix 4 reicht nicht aus.
- die Verwendung des GMP+-Logos gemäß F0.1 Rechte und Pflichten
- die Bestimmung (sofern zutreffend), dass bei einer festgestellten Nonconformity im Hinblick auf ein zulässiges Kontaminationsniveau das nach GMP+ zertifizierte Unternehmen verpflichtet ist, eine EWS-Meldung gemäß R1.0 Feed Safety Management Systems Requirements vorzunehmen
- die Verpflichtung zur Mitwirkung der antragstellenden Organisation bzw. des nach GMP+ zertifizierten Unternehmens an Witness-Audits, Parallel-Audits (im Sinne von CR1.0 Akzeptierungsanforderungen).
- die Weiterleitung von Auditberichten/Auditchecklisten an GMP+ International
- die Option, den Zertifizierungsvertrag vor Ende des Zertifizierungszyklus zu beenden.
- gegebenenfalls das unangekündigte Audit (siehe § 5.2.1.4.2 des vorliegenden Dokuments).
- die Möglichkeit, dass das nach GMP+ zertifizierte Unternehmen im Falle eines unbefriedigenden Beschwerdeverfahrens das Dokument F0.5 Schiedsordnung anwenden kann.
5.1.4. Zuordnung des Audit- bzw. Inspektionsteams
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.2.2 |
In Bezug auf § 9.2.2.1.2 gilt außerdem die zusätzliche Anforderung aus § 4.3.6 von CR 1.0 Akzeptierungsvoraussetzungen.
5.1.4.1. Rotation von Auditoren/Inspektoren
Ein Auditor darf nicht mehr als drei Jahre hintereinander demselben nach GMP+ zertifizierten Unternehmen zugewiesen werden. Wenn kein alternativer Auditor verfügbar ist, kann die Zertifizierungsstelle eine Ausnahme machen und den Zeitraum um höchstens drei weitere Jahre verlängern. Die Entscheidung muss begründet und dokumentiert werden.
Rotation von Auditoren/Technischen Experten mit dem Anwendungsbereich Registriertes Labor :
- Der Auditor und der technische Experte dürfen die Desk-Studie für dasselbe nach GMP+ zertifizierte Unternehmen höchstens sechsmal in Folge ausführen. Anschließend müssen der Auditor und der technische Experte ausgetauscht werden.
Rotation von Inspektoren:
- Nach drei einander folgenden Inspektionen muss ein neuer Inspektor benannt werden.
5.1.5. Auditplan
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.2.3 |
Außerdem muss die antragstellende Organisation bzw. das nach GMP+ zertifizierte Unternehmen auf entsprechende Aufforderung der Zertifizierungsstelle folgende Dokumentation vorlegen:
- Organigramm und kurze Prozessbeschreibungen
- Liste der nach GMP+ gesicherten Produkte
- Informationen über den Produktionsstandort und/oder Nachunternehmer
- das FSMS-Handbuch am Standort beim Audit (gedruckte oder elektronische Fassung)
- Liste der geltenden Vorschriften
- alle weiteren Informationen, die der Auditor/Eigentümer des Unternehmens eventuell für nützlich/zutreffend hält.
Die Auswahl des gesamten zutreffenden Personals, das befragt werden soll, muss alle zutreffenden Funktionsbereiche angemessen abdecken.
Für das Surveillance Audit oder Rezertifizierungsaudit muss das nach GMP+ zertifizierte Unternehmen der Zertifizierungsstelle die folgende Dokumentation/Information zur Verfügung stellen:
- Änderungen in der Organisation
- Änderungen am FSMS-Handbuch
- Änderungen der geltenden Gesetze
- Informationen zum Anwendungsbereich
- sowie alle weiteren zutreffenden Informationen.
Für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln gilt kein Auditplan.
5.2. Zertifizierungsverfahren
5.2.1. Audits/Inspektionen
5.2.1.1. Allgemeines
Eine von GMP+ International im Rahmen des GMP+ Feed Certification scheme akzeptierte Zertifizierungsstelle ist berechtigt, über die Zertifizierungsstelle Unternehmen zu zertifizieren, die ein Interesse an einem oder mehr GMP+-Anwendungsbereichen für die Futtermittelwirtschaft im Sinne des GMP+ Feed Certification scheme haben.
Die antragstellende Organisation bzw. das nach GMP+ zertifizierte Unternehmen muss wie in diesem Dokument festgelegt umfassend an Audits mitwirken. Bei den Audits/Inspektionen muss der Prozess, für den das Unternehmen zertifiziert ist, in Betrieb sein, damit eine Verifizierung stattfinden kann. Die Entnahme von Produktproben und Laboruntersuchungen können Teile des Audits sein.
Über die Zertifizierungsstelle erfolgt die Bewertung mittels eines Audits bzw. einer Inspektion bei der antragstellenden Organisation bzw. dem nach GMP+ zertifizierten Unternehmen auf Konformität des/der geltenden Anwendungsbereichs/-bereiche auf der Grundlage der allgemeinen Anforderungen, die in Appendix 1 festgelegt sind, und den zusätzlichen Bewertungskriterien in den Checklisten.
Das gilt für folgende Audits:
- Zertifizierungsaudit
- Angekündigtes Überwachungsaudit
- Unangekündigtes Überwachungsaudit
- Inspektion
- Rezertifizierungsaudit
- Zusatzaudit
- Dokumentenbewertung
Weitere Anforderungen:
- Die Bewertung für den Anwendungsbereich Registriertes Labor wird über eine Desk-Studie (oder, sofern zutreffend, vor Ort) durchgeführt.
- Die administrative Bewertung des Anwendungsbereichs Laboruntersuchungen muss, sofern alle Analysen nach ISO 17025 akkreditiert sind, einmal jährlich durchgeführt werden.
- Die Bewertung des Anwendungsbereichs Laboruntersuchungen vor Ort muss, sofern nicht alle Analysen nach ISO/IEC17025 akkreditiert sind, für die nicht nach ISO/IEC17025 akkreditierten Analysen einmal jährlich durchgeführt werden
- Die Bewertung des Anwendungsbereichs Laboruntersuchungen vor Ort muss, sofern das Labor nicht nach ISO/IEC17025 akkreditiert ist, einmal jährlich als Systembewertung durchgeführt werden.
Darüber hinaus können auch Sonderaudits durchgeführt werden (siehe § 5.2.2.).
Der Zertifizierungszyklus hat eine Dauer von höchstens drei Jahren. Während jedem der nachstehenden Audits müssen alle Anforderungen bewertet werden: Erstzertifizierung, (un)angekündigtes Überwachungsaudit und Rezertifizierungsaudit. Der verpflichtete Mindestzeitaufwand und Turnus sind in Appendix 2 und Appendix 4 festgelegt.
Wenn ein nach GMP+ zertifiziertes Unternehmen während des Zertifizierungszyklus seine Tätigkeiten und/oder seinen Standort ändert, muss das GMP+ Zertifizierte Undernehmen über die Zertifizierungsstelle vor Ort auditiert werden.
Das gilt für Herstellung, Transport sowie Lagerung und Umschlag. Es gilt der GMP+-Auditzeitaufwand. Die Entscheidung, ob ein Erstzertifizierungsaudit oder ein Überwachungsaudit durchgeführt werden soll, trifft die Zertifizierungsstelle.
5.2.1.2. Eröffnungsgespräch
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.4.2 |
Gilt außerdem nicht für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln.
5.2.1.3. Zertifizierungsaudit
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.3.1 |
| ISO/22003-1:2022(E) | § 9.3.2 bis einschließlich 9.3.4 |
Ob ein GMP+-Zertifikat erteilt werden kann, hängt davon ab, wie die Bewertungskriterien dieses Dokuments erfüllt werden. Ein Erstzertifizierungsaudit muss innerhalb von drei Monaten nach Abschluss eines Zertifizierungsvertrags mit der antragstellenden Organisation durchgeführt werden. Das Intervall zwischen Phase 1 und Phase 2 darf höchstens vier Monate betragen.
Sofern die in Appendix 5 „Auditierung nicht am Standort des nach GMP+ zertifizierten Unternehmens“ und/oder Appendix 6 „Fernaudits“ beschriebenen spezifischen Anforderungen erfüllt sind, kann das Erstzertifizierungsaudit entsprechend durchgeführt werden.
Anwendungsbereich Laboruntersuchungen:
Beim Erstzertifizierungsaudit müssen mindestens die wichtigsten Analysen bewertet werden. Während des Zertifizierungszyklus müssen alle Analysen bewertet werden.
5.2.1.3.1. Befristete Zulassung
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.3.1.2 |
| ISO/22003-1:2022(E) | § 9.3.2 bis einschließlich 9.3.4 |
Es ist möglich, auf Basis einer positiven Bewertung von Phase 1 der Dokumentation des Feed safety management system (Sicherheitsmanagementsystem für Futtermittel) eine befristete Zulassung (höchstens vier Monate) als Teil eines Erstzertifizierungsaudits für ein Unternehmen zu erteilen, das seine GMP+-Tätigkeiten beginnt.
Im Hinblick auf den Standort der Bewertung gilt zusätzlich zu § 9.2.3.1.3 ISO/TS22003 Folgendes:
- Wenn ein Unternehmen Herstellungs- und/oder Lager- und/oder Transporttätigkeiten ausführt (mit Ausnahme von Traktionsunternehmen), muss ein Teil der Bewertung der Qualitätsdokumentation an dem oder den Betriebsstandorten stattfinden, damit die die infrastrukturellen Einrichtungen überprüft werden können.
- Wenn das Unternehmen andere Tätigkeiten ausführt, kann ein Teil der Bewertung der Qualitätsdokumentation an dem oder den Betriebsstandorten stattfinden, wenn die Zertifizierungsstelle das für erforderlich hält.
Das gesamte Zertifizierungsverfahren muss innerhalb der Gültigkeitsdauer der befristeten Zulassung abgeschlossen werden, einschließlich der Aktualisierung der GMP+-Unternehmensdatenbank (einschließlich Status und Zertifikatsdaten) über die Zertifizierungsstelle.
Unternehmen, die nicht für eine befristete Zulassung infrage kommen, sind:
- Unternehmen, die von einer anderen Zertifizierungsstelle gewechselt sind
- Unternehmen, die zuvor nach GMP+ zertifiziert waren oder in der Vergangenheit eine befristete Zulassung hatten.
5.2.1.4. Überwachungsaudit
Während des Überwachungsaudits müssen alle Anforderungen verifiziert werden.
Das erste Überwachungsaudit muss jeweils 12 Monate (plus/minus zwei Monate) nach dem Datum der Zertifizierungsentscheidung durchgeführt werden.
Das zweite Überwachungsaudit muss jeweils 24 Monate (plus/minus zwei Monate) nach dem Datum der Zertifizierungsentscheidung durchgeführt werden.
Sofern die in Appendix 5 „Auditierung nicht am Standort des nach GMP+ zertifizierten Unternehmens“ und/oder Appendix 6 „Fernaudits“ beschriebenen spezifischen Anforderungen erfüllt sind, kann das Überwachungsaudit entsprechend durchgeführt werden.
5.2.1.4.1. Angekündigtes Überwachungsaudit
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.6.2 |
5.2.1.4.2. Unangekündigtes Überwachungsaudit
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.6.2 |
Die Zertifizierungsstellen dürfen unangekündigte Überwachungsaudits nicht innerhalb von zwei Monaten vor oder nach der Durchführung anderer Audits (Erstzertifizierungs-, Rezertifizierungs- und angekündigte Überwachungsaudits) einplanen. Jedes nach GMP+ zertifizierte Unternehmen darf im Abstand von zwölf (12) Monaten des Auditzyklus pro Jahr 15 Tage angeben, an denen keine unangekündigten Überwachungsaudits durchgeführt werden können. Wenn dies im Vorfeld nicht angegeben wird, kann das unangekündigte Überwachungsaudit nicht verweigert werden. Die Beurteilung der Stichhaltigkeit der Begründung für den Aufschub des unangekündigten Überwachungsaudits obliegt der Zertifizierungsstelle.
Beispiele für einen stichhaltig begründeten Aufschub des unangekündigten Überwachungsaudits sind:
- Die Zertifizierungsstelle kann den Standort des nach GMP+ zertifizierten Unternehmens wegen Hochwassers oder anderer extremer Witterungsverhältnisse nicht besuchen.
- Der Standort des nach GMP+ zertifizierten Unternehmens ist geschlossen (jährliche Stilllegung, Wartung, Betriebsurlaub) oder der Standort des nach GMP+ zertifizierten Unternehmens führt keine GMP+-Tätigkeiten durch (Saisonarbeit).
Es gelten die folgenden Ankündigungsfristen für die Durchführung der unangekündigten Überwachungsaudits:
- nach GMP+ zertifizierte Unternehmen (Hersteller) mit Sitz in den Niederlanden: nicht gestattet
- nach GMP+ zertifizierte Unternehmen (Hersteller) mit Sitz in Deutschland: ein Werktag
- nach GMP+ zertifizierte Unternehmen (Hersteller) mit Sitz in anderen europäischen Ländern: zwei Werktage.
- nach GMP+ zertifizierte Unternehmen (Hersteller) mit Sitz außerhalb Europas: drei Werktage.
Es gibt verschiedene Optionen:
A: Obligatorisches unangekündigtes Überwachungsaudit
Das unangekündigte Überwachungsaudit ist obligatorisch für nach GMP+ zertifizierte Unternehmen in Europa, die für einen der folgenden Anwendungsbereiche zertifiziert sind:
- Herstellung von Mischfuttermitteln (einschl. Heimtierfuttermitteln)
- Herstellung von Vormischungen
- Herstellung von Zusatzstoffen
- Herstellung von Einzelfuttermitteln (einschl. Heimtierfuttermitteln).
Das unangekündigte Überwachungsaudit ersetzt eines der angekündigten Überwachungsaudits im Zertifizierungszyklus und muss in der GMP+- Unternehmensdatenbank erfasst werden.
Möglichkeit B: Freiwilliges unangekündigtes Überwachungsaudit
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.6.2 |
Alle, die sich für ein freiwilliges unangekündigtes Audit anmelden, sind verpflichtet, am gesamten Zertifizierungszyklus teilzunehmen. Das unangekündigte Überwachungsaudit ersetzt eines der angekündigten Überwachungsaudits im Zertifizierungszyklus und muss in der GMP+- Unternehmensdatenbank erfasst werden.
B1) Für europäische nach GMP+ zertifizierte Unternehmen, die für einen oder mehrere der folgenden Anwendungsbereiche zertifiziert sind:
- Handel mit Futtermitteln
- Lagerung und Umschlag von Futtermitteln
- Straßentransport von Futtermitteln
- Schienentransport von Futtermitteln
- Befrachtung (alle Anwendungsbereiche).
Europäische nach GMP+ zertifizierte Unternehmen (einschließlich nach GMP+ zertifizierter Unternehmen mit Sitz in den Niederlanden und Deutschland), die für einen der Herstellungsanwendungsbereiche zertifiziert sind und daher verpflichtet sind, an einem unangekündigten Überwachungsaudit für den Herstellungsanwendungsbereich teilzunehmen, können entscheiden, ob sie das unangekündigte Überwachungsaudit auch auf einen der unter Option B1 genannten Anwendungsbereiche anwenden wollen.
B2) Für alle nichteuropäischen nach GMP+ zertifizierten Unternehmen, die für einen GMP+-Anwendungsbereich zertifiziert sind.
Das unangekündigte Audit kann freiwillig auf alle Anwendungsbereiche im jeweiligen Land angewendet werden.
5.2.1.5. Inspektion
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17020:2012 | § 7.1 |
Über die Zertifizierungsstelle wird eine Zertifizierungsinspektion durchgeführt, um zu beurteilen, ob das Unternehmen die Kriterien aus der Checkliste für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln erfüllt. Die Zertifizierungsinspektion muss innerhalb von drei Monaten nach Abschluss eines Zertifizierungsvertrags mit der antragstellenden Organisation durchgeführt werden.
5.2.1.6. Rezertifizierungsaudit
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.6.3 |
Ob ein GMP+-Zertifikat verlängert werden kann, hängt davon ab, wie die Bewertungskriterien aus Appendix 1 dieses Dokuments oder aus der GMP+-Checkliste für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln erfüllt werden. Bevor die Gültigkeitsdauer des Zertifikats endet, muss das gesamte Zertifizierungsverfahren abgeschlossen sein, einschließlich der Aktualisierung der GMP+-Unternehmensdatenbank (Status und Zertifikatsdaten) über die Zertifizierungsstelle.
Wenn ein Rezertifizierungsaudit bzw. eine Rezertifizierungsinspektion nicht vor Ende der Gültigkeitsdauer des Zertifikats durchgeführt wird, muss ein Erstzertifizierungsaudit bzw. eine Erstzertifizierungsinspektion durchgeführt werden. In der Zwischenzeit ist das nach GMP+ zertifizierte Unternehmen nicht GMP+-zertifiziert. Sofern die in Appendix 5 „Auditierung nicht am Standort des nach GMP+ zertifizierten Unternehmens“ und/oder Appendix 6 „Fernaudits“ beschriebenen spezifischen Anforderungen erfüllt sind, kann das Rezertifizierungsaudit entsprechend durchgeführt werden.
5.2.1.7. Zusatzaudit
Wenn ein nach GMP+ zertifiziertes Unternehmen den Anwendungsbereich der bereits erteilten Zertifizierung um einen oder mehrere weitere Anwendungsbereiche erweitern will und die Erweiterung nicht bis zum nächsten Audit warten kann, muss die Erweiterung von der Zertifizierungsstelle bewertet werden.
Ein Zusatzaudit (Phase 1 und Phase 2) darf sich ausschließlich auf Tätigkeiten konzentrieren, die von der Erweiterung abgedeckt sind.
Aufgrund einer positiven Bewertung der Erweiterung muss die Zertifizierungsstelle den oder die zusätzlichen Anwendungsbereiche hinzufügen:
- zum GMP+-Zertifikat
- zur GMP+-Unternehmensdatenbank
- zum GMP+-Zertifizierungsvertrag mit dem nach GMP+ zertifizierten Unternehmen.
5.2.2. Sonderaudits
Es können die nachstehenden Sonderaudits gelten. Deren Bewertung muss im Sinne von Appendix 1 oder der GMP+-Checkliste für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln erfolgen.
5.2.2.1. Verschärftes Kontrollaudit
Wenn die Zertifizierungsstelle eine oder mehrere MajorNonconformities feststellt, kann das nach GMP+ zertifizierte Unternehmen für ein Audit unter verschärfte Kontrolle gestellt werden.
- Die Kosten dieses Audit gehen zulasten des nach GMP+ zertifizierten Unternehmens.
- Dieses Audit stellt eine Ergänzung des normalen Auditzyklus dar.
- Das verschärfte Überwachungsaudit findet innerhalb von drei Monaten statt.
- Die Bewertung basiert auf der festgestellten Major Nonconformity, ist aber nicht darauf beschränkt.
- Eine Major Nonconformity kann auch administrativ auf Grundlage der Konformitätsmaßnahmen abgehandelt werden, die vom nach GMP+ zertifizierten Unternehmen formuliert wurden.
Wenn die Zertifizierungsstelle eine oder mehrere CriticalNonconformities feststellt, muss das nach GMP+ zertifizierte Unternehmen auf jeden Fall unter verschärfte Kontrolle gestellt werden.
- Die Kosten dieser Audits gehen zulasten des nach GMP+ zertifizierten Unternehmens.
- Diese Audits stellen eine Ergänzung zum normalen Auditzyklus dar.
- Die verschärften Überwachungsaudits werden monatlich durchgeführt, und zwar mindestens drei und höchstens sechs Monate lang.
- Die Bewertung basiert auf der festgestellten Critical Nonconformity, ist aber nicht darauf beschränkt.
- Es muss ein verschärftes Überwachungsaudit am Standort durchgeführt werden. Die Entscheidung, ob noch weitere verschärfte Überwachungsaudits erforderlich sind, obliegt der Zertifizierungsstelle. Diese Entscheidung muss begründet und dokumentiert werden.
5.2.2.2. Wiederholungsaudit (RPA) und Wiederholungsinspektion (RI)
Ein Wiederholungsaudit bzw. eine Wiederholungsinspektion muss unter der Verantwortung der Zertifizierungsstelle durchgeführt werden. Grund für ein Wiederholungsaudit bzw. eine Wiederholungsinspektion können eine EWS- Meldung, Beschwerden oder Zwischenfälle oder sonstige besondere Umstände sein.
Das Wiederholungsaudit bzw. die Wiederholungsinspektion konzentriert sich im Prinzip auf diesen Grund/diese Gründe, kann aber auch auf alle Anforderungen des GMP+ Feed Certification scheme ausgerichtet sein.
- GMP+ International kann die Zertifizierungsstelle auffordern, grundsätzlich kurzfristig ein Wiederholungsaudit bzw. die Wiederholungsinspektion in Anwesenheit eines Auditors von GMP+ International und/oder eines Sachkundigen durchzuführen.
- Das Wiederholungsaudit bzw. die Wiederholungsinspektion muss von einem GMP+-Auditor/Inspektor durchgeführt werden. Die beteiligte Zertifizierungsstelle muss die Wahl des GMP+-Auditors/Inspektor begründen und ihre Entscheidung dokumentieren.
- Die Frist wird von Fall zu Fall bewertet, aber letztendlich von GMP+ International festgelegt. Das Audit bzw. die Wiederholungsinspektion wird am Standort durchgeführt. Ferner können Kontrollen verwaltungstechnische Kontrollen sowie eine Probenahme durchgeführt werden.
- Die erforderlichen Vereinbarungen und die Kommunikation über das Wiederholungsaudit werden von der Zertifizierungsstelle nach Rücksprache mit GMP+ International mit dem nach GMP+ zertifizierten Unternehmen getroffen.
- Die Kosten des Wiederholungsaudits bzw. die Wiederholungsinspektion gehen grundsätzlich zulasten von GMP+ International. Wenn sich allerdings herausstellt, dass eine oder mehrere Critical oder Major Nonconformities festgestellt werden, werden die Kosten dem nach GMP+ zertifizierten Unternehmen in Rechnung gestellt.
5.2.3. Außerordentliche Ereignisse
Wenn die Zertifizierungsstelle und/oder Critical Location mit einem außerordentlichen Ereignis konfrontiert wird, kann GMP+ International diesen Status weitergeben. Sofern es sich um ein außerordentliches Ereignis im Hinblick auf ein spezifisches Unternehmen handelt, muss sich die Zertifizierungsstelle mit GMP+ International in Verbindung setzen, um diesen Status zu bestätigen. Nach der Bestätigung seitens GMP+ International ist die Zertifizierungsstelle verpflichtet, die nachstehenden Richtlinien auf der Grundlage des informativen Dokuments der IAF über den Umgang mit außergewöhnlichen Ereignissen oder Umständen, die sich auf Zertifizierungsstellen und Teilnehmer auswirken, zu befolgen, die folgendermaßen lauten:
- Das nach GMP+ zertifizierte Unternehmen oder der Betriebsstandort existiert nicht, weil es oder er durch Terrorakte oder Kriegshandlungen zerstört wurde oder von Streitkräften oder Rebellen übernommen wurde und/oder durch pandemische Überschwemmungen, Erdbeben oder andere von Menschenhand verursachte und Naturkatastrophen zerstört wurde. Die Zertifizierungsstelle, Critical/Non-Critical Location wird von der Geschäftsführung des nach GMP+ zertifizierten Unternehmens oder des Betriebsstandorts informiert oder erhält die Informationen aus anderen Quellen. Die Zertifizierungsstelle, Critical/Non-Critical Location ist verpflichtet, über eine zuverlässige Quelle eine Bestätigung des Ereignisses zu ermitteln. Nach der Bestätigung entzieht die Zertifizierungsstelle das GMP+-Zertifikat, und GMP+ International wird unverzüglich schriftlich unter Angabe aller zutreffenden Daten informiert.
- Der Hauptstandort hat das nach GMP+ zertifizierte Unternehmen oder den Betriebsstandort geschlossen, weil die Region nicht sicher ist. Die Geschäftsführung des Unternehmens am Hauptstandort informiert die Zertifizierungsstelle, Critical/Non-Critical Location. Die Zertifizierungsstelle entzieht das GMP+-Zertifikat, und GMP+ International wird unverzüglich schriftlich unter Angabe aller zutreffenden Daten informiert. Ein Audit des nach GMP+ zertifizierten Unternehmens oder des Betriebsstandorts ist nicht möglich, da GMP+ International bestätigt das außerordentliches Ereignis, die Zertifizierungsstelle, Critical/Non-Critical Location müssen dabei gemäß einer der beiden nachstehenden Bestimmungen vorgehen:
- Wenn der Auditturnus nicht eingehalten werden kann und vorausgesetzt werden kann, dass hinreichend Beweise vorliegen, um davon auszugehen, dass das zertifizierte Managementsystem des nach GMP+ zertifizierten Unternehmens effektiv ist, kann in Erwägung gezogen werden, das Überwachungs- oder Rezertifizierungsaudit für einen Zeitraum von höchstens drei Monaten aufzuschieben. Ansonsten muss die Zertifizierungsstelle das GMP+-Zertifikat aussetzen. Das Überwachungs- oder Rezertifizierungsaudit muss während der Aussetzung durchgeführt werden; andernfalls muss die Zertifizierungsstelle das Zertifikat entziehen.
- Vollständige Fernaudits oder Begleitete Fernaudits sind gemäß den Anforderungen und Bestimmungen aus Appendix 6 des vorliegenden Dokuments durchzuführen.
- Sofern die in Appendix 6 „Fernaudits“ beschriebenen spezifischen Anforderungen erfüllt sind, können die Audits entsprechend durchgeführt werden.
5.2.4. Bestimmung und Aufzeichnung von Audit- und Inspektionsfeststellungen
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.4.5 und 9.4.6 |
| ISO/IEC 17020:2012 | § 7.4 (gilt ausschließlich für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln) |
Wenn die antragstellende Organisation bzw. das nach GMP+ zertifizierte Unternehmen die Anforderungen des GMP+ Feed Certification scheme nicht erfüllt, gelten die Maßnahmen und Sanktionen, die in Appendix 1 angegeben sind.
Außerdem gilt für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln Folgendes: Wenn eine „Nicht konform“-Bewertung mit einer Beschreibung festgelegt wird, kann kein GMP+-Zertifikat ausgestellt werden. Das GMP+-Zertifikat kann nur ausgestellt werden, wenn die „Nicht konform“-Bewertung mit einer Beschreibung aufgehoben wurde.
Wird eine Nonconformity in einem der FSA-Anwendungsbereiche in Kombination mit einem gleichwertigen System gemäß Abschnitt 3 von TS1.2 Beschaffung oder mit FRA festgestellt, gilt sie sowohl für die FSA- als auch für die FRA-Anwendungsbereiche.
Matrixzertifizierung:
Wenn am Hauptstandort Nonconformities festgestellt werden, gelten diese Nonconformities für die gesamte GMP+-Matrixzertifizierung. Wenn auf Standortebene Nonconformities festgestellt werden, kann das Auswirkungen auf den Standort und/oder Hauptstandort haben. Das muss über die Zertifizierungsstelle bewertet werden. Auditfeststellungen für die einzelnen Matrixzertifizierungsstandorte müssen als maßgeblich für das gesamte System erachtet werden, d.h. dass Korrekturmaßnahmen entsprechend umgesetzt werden müssen.
5.2.5. Abschlussgespräch
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.4.7 |
Gilt außerdem nicht für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln.
5.2.6. Auditbericht/Checkliste
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.4.8 |
| ISO/IEC 17020:2012 | § 7.4 (gilt ausschließlich für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln) |
Die Berichte für alle Audittypen orientieren an den Berichtvorlagen in Appendix 3.
Die Zertifizierungsstelle schickt der antragstellenden Organisation bzw. dem nach GMP+ zertifizierten Unternehmen innerhalb von spätestens acht Wochen nach der Durchführung des Audits bzw. der Inspektion den GMP+-Auditbericht/die Checkliste zu.
Die Zertifizierungsstelle muss eine(n) schriftliche(n) GMP+- Auditbericht für jeden Matrixzertifizierungsstandort bereitstellen, der auditiert wird. Der GMP+-Auditbericht kann auch in den GMP+-Auditbericht des Hauptstandorts aufgenommen werden.
In diesem Fall muss der GMP+-Auditbericht des Hauptstandorts eine Übersicht enthalten, aus der hervorgeht, wann die einzelnen Standorte/Unternehmen auditiert wurden. In beiden Fällen muss für jeden Matrixzertifizierungsstandort eine Checkliste mit den Konformitäten bzw. Nichtkonformitäten in die GMP+-Unternehmensdatenbank hochgeladen werden. Der Nachweis, dass die Anforderungen erfüllt sind, kann auch zum GMP+-Auditbericht bzw. zur Checkliste des Hauptstandorts hinzugefügt werden.
Wenn GMP+ International den GMP+-Auditbericht/die Checkliste anfordert, muss die Zertifizierungsstelle dieses Dokument unverzüglich bereitstellen. Bei einem Wiederholungsaudit bzw. einer Wiederholungsinspektion muss der GMP+-Auditbericht/die Checkliste innerhalb von 5 Werktagen bei GMP+ International eingehen.
Die folgenden Informationen müssen für alle Audittypen/Inspektionen (einschließlich Dokumentenprüfung) in die GMP+- Unternehmensdatenbank eingegeben und spätestens innerhalb von 8 Wochen nach Durchführung des Audits am Standort mit GMP+ International geteilt werden:
- Auditfeststellungen/Checkliste
- Nonconformities (sofern zutreffend)
- Endbeurteilung der antragstellenden Organisation bzw. des nach GMP+ zertifizierten Unternehmens
5.2.7. Berichtsprüfung
Die Zertifizierungsstelle muss über ein Verfahren verfügen, mit dem alle GMP+-Audit/Inspektionsberichte/Checklisten wirksam geprüft werden können, einschließlich der Frage:
- ob die vom Auditteam erteilten Informationen im Zusammenhang mit den Zertifizierungsanforderungen und dem Anwendungsbereich für die Zertifizierung ausreichen
- ob sie für jeden Typ der Nonconformities die Korrektur und die Korrekturmaßnahmen geprüft, genehmigt und bewertet hat
- ob die Bewertung der antragstellenden Organisation bzw. des nach GMP+ zertifizierten Unternehmens in Übereinstimmung mit dem/den geltenden Anwendungsbereich(en) auf der Grundlage der allgemeinen Kriterien im Sinne von Appendix 1 und der ergänzenden Bewertungskriterien aus der Checkliste stattgefunden hat.
Die Schlussfolgerung und das Datum der Berichtsprüfung durch den Technical Reviewer müssen dokumentiert werden.
Der Technical Reviewer muss die Berichtsprüfung unabhängig durchführen, d.h. dass der Technical Reviewer kein Mitglied des GMP+-Auditteams sein durfte, auch nicht als Stellvertreter.
5.2.8. Zertifizierungsentscheidung
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9,5 |
Darüber hinaus müssen die Beurteilungskriterien aus Appendix 1 dieses Dokuments und/oder die Kriterien aus der Checkliste für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln erfüllt sein.
5.2.9. Zertifikat und befristete Zulassung
5.2.9.1. Zertifikate
Ein Zertifikat mit einer maximalen Gültigkeitsdauer von drei Jahren gerechnet ab dem Datum der positiven Zertifizierungsentscheidung kann über die Zertifizierungsstelle erteilt werden. Die maximale Gültigkeitsdauer für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln beträgt 2 Jahre ab dem Datum einer positiven Zertifizierungsentscheidung. Die Gültigkeitsdauer des GMP+-Zertifikats darf die Gültigkeitsdauer des Zertifizierungsvertrags nicht überschreiten.
Innerhalb von acht Wochen nach der Durchführung des Audits bzw. der Inspektion wird der antragstellenden Organisation bzw. dem nach GMP+ zertifizierten Unternehmen über die Zertifizierungsstelle das Zertifikat zugeschickt.
Bei einem Matrixzertifizierungsstandort muss deutlich sein, wofür der Matrixzertifizierungsstandort gemäß F0.3 Anwendungsbereiche für die Zertifizierung zertifiziert ist. Der Hauptstandort muss für die Anwendungsbereiche zertifiziert sein, die alle Tätigkeiten der Matrixzertifizierungsstandorte umfassen.
Für die Erteilung eines Zertifikats gilt Folgendes:
- Der zertifizierte Matrixzertifizierungsstandort kann in einen Appendix aufgenommen werden, der an das Zertifikat des Hauptstandorts geknüpft ist.
- Oder es kann für jeden zertifizierten Matrixzertifizierungsstandort ein individuelles Zertifikat erteilt werden, das Folgendes enthalten muss.
- Die Tätigkeiten, die für den spezifischen Standort/die juristische Person durchgeführt werden, für die die Zertifizierung vorgenommen wurde.
- Das Hauptzertifikat muss rückverfolgbar sein, beispielsweise anhand eines Codes.
Hilfreicher Tipp
Wenn der GMP+-Hauptstandort für die Anwendungsbereiche Herstellung von Mischfuttermitteln und Handel mit Futtermitteln zertifiziert ist und die Matrixzertifizierungsstandorte einen Transport-Anwendungsbereich haben, muss der GMP+-Hauptstandort auch für diesen Anwendungsbereich zertifiziert sein, weil die Verwaltung und Kontrolle des Feed safety management system über die Matrixzertifizierungskonstruktion vom GMP+-Hauptstandort zentral gesteuert wird.
5.2.9.2. Befristete Zulassung
Eine befristete Zulassung mit einer maximalen Gültigkeitsdauer von vier Monaten kann über die Zertifizierungsstelle erteilt werden. Die Gültigkeitsdauer der befristeten Zulassung darf die Gültigkeitsdauer des Zertifizierungsvertrags nicht überschreiten.
Wenn sich jedoch herausstellt, dass das Erstzertifizierungsaudit (Phase 2) der antragstellenden Organisation nicht den GMP+-Anforderungen an den/die geltenden Anwendungsbereich(e) auf der Grundlage der allgemeinen Kriterien im Sinne von Appendix 1 entspricht, muss die befristete Zulassung wieder entzogen werden.
Für einen Matrixzertifizierungsstandort gilt Folgendes:
- Für jeden Matrixzertifizierungsstandort wird eine befristete Zulassung erteilt oder in einem Appendix angegeben, der an eine befristete Zulassung des Hauptstandorts geknüpft ist.
- Es muss deutlich sein, wofür der Matrixzertifizierungsstandort gemäß F0.3 Anwendungsbereiche für die Zertifizierung zertifiziert ist.
5.2.9.3. Zertifikat und befristete Zulassungsvorlagen
Die Zertifizierungsstelle muss im Zertifikat oder in der befristeten Zulassung folgenden Text verwenden:
- Text für Zertifikat Feed Safety Assurance
| Name der Zertifizierungsstelle: Registriernummer der Zertifizierungsstelle bei GMP+ International: Zertifikat „GMP+ FSA“-Logo Name, Adresse, Standort des nach GMP+ zertifizierten Unternehmens (Adresse, an der die GMP+-Tätigkeiten stattfinden) Name und EU-Nummer des Fahrzeugs, sofern zutreffend Registriernummer des nach GMP+ zertifizierten Unternehmens bei GMP+ International FESTER TEXTABSCHNITT =Name der Zertifizierungsstelle= erklärt, dass berechtigterweise davon auszugehen ist, dass der oder die GMP+-Anwendungsbereiche =Anwendungsbereich(e) im Sinne von F 0.3 `Anwendungsbereiche für die Zertifizierung´= beim nach GMP+ zertifizierten Unternehmen =Name des nach GMP+ zertifizierten Unternehmens= die geltenden Anforderungen und Bedingungen des GMP+ Feed Safety Assurance Module 2020 erfüllen. „Das Futtermittelmanagementsystem der gesamten Matrixzertifizierungskonstruktion ist zertifiziert, und die Gültigkeit dieses Zertifikats hängt von der Gültigkeit des Zertifikats des Hauptstandorts ab.“1 ABSCHNITT FÜR FREIE EINGABE Siehe F0.3 Anwendungsbereich für die Zertifizierung - Optional Specification Eingetragener Sitz der Zertifizierungsstelle Akkreditierungszeichen (sofern zutreffend) Zertifikatnummer Anfangs- und Ablaufdatum des Zertifikats |
1Dieser Satz muss ausschließlich im Falle eines individuellen Zertifikats im Rahmen einer Matrixzertifizierung in das Zertifikat aufgenommen werden.
B) Text für eine befristete Zulassung
| Name der Zertifizierungsstelle: Registriernummer der Zertifizierungsstelle bei GMP+ International: Befristete Zulassung Name, Adresse, Standort des befristet zugelassenen Unternehmens (Adresse, an der die GMP+-Tätigkeiten stattfinden) Name und EU-Nummer des Fahrzeugs, sofern zutreffend Registriernummer des befristet zugelassenen Unternehmens bei GMP+ International FESTER TEXTABSCHNITT =Name der Zertifizierungsstelle= erklärt, dass berechtigterweise davon auszugehen ist, dass der oder die GMP+-Anwendungsbereiche =Anwendungsbereich(e) im Sinne von F0.3 `Anwendungsbereich für die Zertifizierung´= beim von GMP+ befristet zugelassenen Unternehmen =Name des von GMP+ befristet zugelassenen Unternehmens= die Kriterien einer Bewertung der Phase 1 der geltenden Anforderungen und Bedingungen des GMP+ Feed Safety Assurance Module 2020 erfüllen. „Das Futtermittelmanagementsystem der gesamten Matrixzertifizierungskonstruktion ist befristet zugelassen, und die Gültigkeit dieser Befristete Zulassung hängt von der Gültigkeit der Befristete Zulassung des Hauptstandorts ab.“1 ABSCHNITT FÜR FREIE EINGABE Siehe F0.3 Anwendungsbereich für die Zertifizierung - Optional Specification Eingetragener Sitz der Zertifizierungsstelle Befristete Zulassungsnummer Anfangs- und Ablaufdatum der befristeten Zulassung |
1 Dieser Satz muss ausschließlich im Falle eines individuellen Zertifikats im Rahmen einer Matrixzertifizierung in das Zertifikat aufgenommen werden.
- Text für ein Zertifikat für den Anwendungsbereich Registriertes Labor :
| Name der Zertifizierungsstelle: Registriernummer der Zertifizierungsstelle bei GMP+ International
Zertifikat „GMP+ FSA“-Logo TS 4.2 Registrierte Labore Name, Standort des nach GMP+ zertifizierten Unternehmens Internationale Registriernummer des nach GMP+ zertifizierten Unternehmens
Die Zertifizierungsstelle =Name der Zertifizierungsstelle= bescheinigt, dass das nach GMP+ zertifizierte Unternehmen =Name des nach GMP+ zertifizierten Unternehmens= gemäß den zutreffenden Anforderungen aus TS 4.2 Registrierte Labore und dem GMP+ Feed Safety Assurance Module 2020 auditiert worden ist.
Die Zertifizierungsstelle =Name der Zertifizierungsstelle= bescheinigt auf der Grundlage einer Desk-Studie, dass hinsichtlich der nachstehenden Analysen die Leistungskriterien im Sinne von TS 4.2 Registrierte Labore erfüllt werden:
Registrierte Geschäftsstelle der Zertifizierungsstelle Zertifikatnummer Anfangs- und Ablaufdatum des Zertifikats | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ergänzend für Zertifikatsvorlagen und befristete Zulassungen ist Folgendes zutreffend:
- Die Daten des nach GMP+ zertifizierten Unternehmens bzw. des befristet zugelassenen Unternehmens müssen identisch sein mit den Daten, die im offiziellen Unternehmensregister erfasst sind (beispielsweise Handelskammer/Erfassung durch die zuständige Behörde, Steuer-/Umsatzsteuernummer).
- Das „GMP+ FSA“-Logo
- Es ist nicht gestattet, das „GMP+ FSA“-Logo auf einer vorübergehenden Zulassung zu verwenden. Außerdem darf das Dokument nicht als „Zertifikat“ bezeichnet werden, sondern muss als „befristete Zulassung“ benannt werden.
- Es ist ausschließlich der von GMP+ akzeptierten Zertifizierungsstelle vorbehalten, die Logos von Critical Location und Non-Critical Location im GMP+-Zertifikat und in der befristeten Zulassung zu verwenden.
- Das Anfangsdatum des Zertifikats/der befristeten Zulassung entspricht auf jeden Fall dem Datum vor oder nach der positiven Entscheidung über die Zertifizierung/befristete Zulassung.
- Bei einer Erweiterung der Anwendungsbereiche kann das Ablaufdatum des gültigen GMP+-Zertifikats nicht verlängert werden. Die Zertifizierungsstelle kann dem nach GMP+ zertifizierten Unternehmen für den zusätzlichen Anwendungsbereich auch ein neues GMP+-Zertifikat zuerkennen.
- Es ist nicht gestattet, das Zertifikat oder die befristete Zulassung auf welche Weise auch immer für spezifische Markennamen zu erteilen.
- (Vertragliche) Anforderungen/Bestimmungen dürfen im GMP+-Zertifikat oder der befristete Zulassung nicht genannt werden.
5.3. Aussetzung oder Entzug eines Zertifikats und einer befristeten Zulassung
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.6.5.1 |
Wenn festgestellt wird, dass ein nach GMP+ zertifiziertes Unternehmen/befristet zugelassenes Unternehmen die Anforderungen nicht mehr erfüllt, müssen über die Zertifizierungsstelle unverzüglich Sanktionen gemäß Appendix 1 verhängt werden.
Der Auditor muss Critical Nonconformities im Sinne von Appendix 1 unverzüglich dem verantwortlichen GMP+-Koordinator.
Davon abweichend gilt für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln Folgendes: Wenn eine „Nicht konform“-Bewertung mit einer Beschreibung festgelegt wird, muss das GMP+-Zertifikat entzogen werden. Das GMP+-Zertifikat kann nur ausgestellt werden, wenn die „Nicht konform“-Bewertung mit einer Beschreibung aufgehoben wurde.
Der verantwortliche GMP+-Koordinator muss GMP+ International innerhalb von zwei Werktagen benachrichtigen, dass die Anforderungen nicht mehr erfüllt werden, und zwar mit dem Formular Audit Finding Notification Critical Nonconformity, wenn Folgendes vorliegt:
- Critical Nonconformity
- Aussetzung des GMP+-Zertifikats
- Entzug des GMP+-Zertifikats.
Über die Zertifizierungsstelle muss der Status in der GMP+-Unternehmensdatenbank innerhalb von zwei Werktagen in „suspendiert oder eingezogen“ geändert werden; als Begründung muss „erfüllt nicht die Anforderungen“ angegeben werden. Wenn die Zertifizierungsstelle eine Critical Nonconformity festgestellt hat, ist es nicht gestattet, das GMP+-Zertifikat mit der Begründung „Kündigung des Vertrags“ zu entziehen. Nach der Aussetzung oder dem Entzug des Zertifikats kann das Unternehmen nicht mehr am GMP+ Feed Certification scheme im Rahmen eines Torwächterprotokolls teilnehmen.
GMP+ International ist berechtigt, die ausgesetzten/entzogenen Zertifikate zu veröffentlichen.
5.4. Wechsel zu einer anderen Zertifizierungsstelle
| Es gelten die zutreffenden Anforderungen | |
| ISO/IEC 17021-1:2015 | § 9.5.3.3 |
Während der Gültigkeitsdauer eines GMP+-Zertifikats hat ein nach GMP+ zertifiziertes Unternehmen das Recht, zu einer anderen Zertifizierungsstelle zu wechseln. Für einen solchen Wechsel gelten die folgenden Anforderungen:
5.4.1. Überprüfung vor dem Wechsel
Die abgebende Zertifizierungsstelle ist verpflichtet, der akzeptierenden Zertifizierungsstelle/Critical Location alle zutreffenden Informationen/Daten zur Verfügung zu stellen.
Die akzeptierende Zertifizierungsstelle muss über einen Prozess verfügen, mit dem sie hinreichend Informationen erlangt, um über die Zertifizierung entscheiden zu können, und muss das nach GMP+ zertifizierte Unternehmen, das zur akzeptierenden Zertifizierungsstelle wechselt, über diesen Prozess in Kenntnis setzen. Diese Informationen müssen mindestens Vereinbarungen über den Zertifizierungszyklus enthalten.
Die akzeptierende Zertifizierungsstelle legt die Kompetenzkriterien für das Personal fest, das an der Überprüfung vor dem Wechsel beteiligt ist. Die Prüfung kann von einer oder mehreren Personen durchgeführt werden. Die Person oder die Personengruppe, die den Review vor dem Wechsel durchführt, muss über dieselbe Kompetenz verfügen, die für ein Auditteam erforderlich ist, das für den geprüften Zertifizierungsanwendungsbereich geeignet ist.
Die akzeptierende Zertifizierungsstelle/Critical Location muss eine Prüfung der Zertifizierung des nach GMP+ zertifizierten Unternehmens durchführen. Diese Prüfung muss folgende Aspekte umfassen, und die Feststellungen müssen dokumentiert werden:
- Bestätigung, dass die Zertifizierung des nach GMP+ zertifizierten Unternehmens in den akzeptierten Geltungsbereich der ausscheidenden und der akzeptierenden Zertifizierungsstelle fällt
- die Gründe für die Beantragung eines Wechsels
- dass der oder die Standorte, der/die die Zertifizierung übertragen möchten, im Besitz eines gültigen Zertifikats sind;
- die Erstzertifizierung der aktuellen Berichte über das Rezertifizierungsaudit und der aktuellste vorläufige Bericht; der Status aller offenen Nonconformities, die sich daraus ergeben können, sowie die gesamte weitere zutreffende Dokumentation im Zusammenhang mit dem Zertifizierungsverfahren;
- für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln eine Auswertung der letzten Checkliste, um festzustellen, ob eine „Nicht konform“-Bewertung mit Beschreibung festgehalten worden ist. Diese Evaluierung kann andere zutreffende Aufzeichnungen in Bezug auf das (Re-)Zertifizierungsverfahren, wie beispielsweise Notizen usw., enthalten.
- wenn eine der offenen Nonconformities als Critical eingestuft ist, ist ein Wechsel nicht gestattet
- erhaltene Beschwerden und getroffene Maßnahmen
- ein eventuell, laufender Vorgang des wechselnden, nach GMP+ zertifizierten Unternehmens bei Aufsichtsbehörden, die für den Zertifizierungsanwendungsbereich im Hinblick auf die Gesetzeskonformität relevant sind
- die Bestätigung, dass das nach GMP+ zertifizierte Unternehmen keine unerfüllten vertraglichen Verpflichtungen gegenüber der abgebenden Zertifizierungsstelle hat.
5.4.2. Zertifizierungsverfahren während des Wechsels
Nach einer erfolgreichen Überprüfung vor dem Wechsel gelten die folgenden Anforderungen:
- Die akzeptierende Zertifizierungsstelle, Critical/Non-Critical Location muss einen GMP+-Zertifizierungsvertrag mit der antragstellenden Organisation schließen (siehe § 5.1.3.) bevor der Unternehmensantrag „Wechsel der Zertifizierungsstelle“ bei GMP+ International eingereicht wird. Es muss ein neuer Zertifizierungszyklus gestartet werden. Es muss ein Erstzertifizierungsaudit durchgeführt werden.
- Offene Nonconformities, die von der abgebenden Zertifizierungsstelle festgestellt wurden, müssen vor dem Wechsel behoben werden; ansonsten müssen die Nonconformities beim Erstzertifizierungsaudit durch die akzeptierende Zertifizierungsstelle/Critical Location behoben werden. Für den Anwendungsbereich Binnen- und Küstenschifffahrtstransporte von Futtermitteln muss eine nicht behobene „Nicht konform“-Bewertung, die während der letzten Inspektion festgelegt worden ist, von der akzeptierenden Zertifizierungsstelle/Critical Location während der Erstinspektion abgewickelt werden.
- Es muss ein neues Zertifikat erteilt werden. Eine Übertragung eines GMP+ Zertifikats von der abgebenden Zertifizierungsstelle auf die akzeptierende Zertifizierungsstelle ist innerhalb von 5 Monaten nach dem Datum der Übertragung nicht gestattet. Eine Zertifizierungsstelle darf den Wechsel eines Unternehmens nicht akzeptieren, wenn das GMP+-Zertifikat dieses Unternehmens ausgesetzt oder entzogen wurde. Eine Ausnahme ist nur möglich, wenn das Zertifikat auf „eigene Antragsaufhebung des Vertrags“ entzogen wurde.
5.4.3. Zusammenarbeit zwischen der abgebenden und der akzeptierenden Zertifizierungsstelle
| Es gelten die zutreffenden Anforderungen | |
| IAF Pflichtdokument für die Übertragung akkreditierter Zertifizierung von Lenkungssystemen – AF MD 2:2017 | § 2.4 |
6. Haftungsausschluss von GMP+ International
GMP+ International übernimmt keinerlei Haftung im Zusammenhang mit der Bewertung von antragstellenden Organisation/nach GMP+ zertifizierten Unternehmen durch die Zertifizierungsstellen. Die betreffenden Zertifizierungsstellen müssen GMP+ International in dieser Hinsicht von jeglicher Haftung freistellen.
7. Gebühren
Jede Zertifizierungsstelle hat ihren eigenen Gebührensatz. Die Zertifizierungsstelle stellt den jeweiligen Gebührensatz im Namen von GMP+ International gemäß GMP+ CR4.0 Gebührenordnung in Rechnung.
8. Streitigkeiten zwischen Zertifizierungsstellen und nach GMP+ zertifizierten Unternehmen
Streitfälle zwischen Zertifizierungsstellen und der antragstellenden Organisation bzw. dem nach GMP+ zertifizierten Unternehmen hinsichtlich der Bewertung werden in erster Instanz gemäß der internen Schiedsordnung der jeweiligen Zertifizierungsstelle abgewickelt. Wenn dies nicht zu einer Lösung führt, kann der Streitfall gemäß F 0.5 Schiedsverfahren abgewickelt werden.
Appendix 1: Bewertungskriterien und Sanktionen für Audits für das GMP+ FSA
Nonconformities müssen auf folgender Grundlage eingestuft werden:
- den allgemeinen Bewertungskriterien im Sinne des vorliegenden Appendix
- den spezifischen Bewertungskriterien im Sinne der Checklisten.
Es müssen mindestens die spezifizierten Sanktionen verhängt werden. Die Zertifizierungsstelle darf härtere Sanktionen verhängen. Wo in dieser Tabelle das Zertifikat genannt ist, gilt das auch für die befristete Zulassung.
| Einstufung: Minor Nonconformity | ||||
| Beschreibung | Konsequenz | Frist zur Behebung | ||
| ICA/RCA | SA | |||
| Nach GMP+ zertifizierte Unternehmen
| < 10 Nonconformities | Zertifikat kann erteilt werden | Zertifizierung kann fortgesetzt werden | beim nächsten Audit vor Ort |
| ≥ 10 Nonconformities | Zertifikat kann nicht erteilt werden | Zertifizierung kann fortgesetzt werden | Innerhalb von 6 Wochen | |
| Einstufung: Major Nonconformity | |||
| Beschreibung | Konsequenz | Frist zur Behebung | |
| ICA/RCA | SA | ||
| Nach GMP+ zertifizierte Unternehmen
| Zertifikat kann nicht erteilt werden | Die Zertifizierung kann fortgesetzt werden, aber es können verschärfte Kontrollen durchgeführt werden (siehe § 5.2.2.1). | Innerhalb von 6 Wochen |
| Einstufung: Critical Nonconformity | |||
| Beschreibung | Konsequenz | Frist zur Behebung | |
| ICA/RCA | SA | ||
| Nach GMP+ zertifizierte Unternehmen
| Zertifikat kann nicht erteilt werden | *Niveau 1 Die Zertifizierung kann fortgesetzt werden, aber es müssen verschärfte Wiederholungsprüfungen durchgeführt werden (siehe § 5.2.2.1). | Innerhalb von 2 Wochen |
| *Niveau 2 Das Zertifikat muss ausgesetzt werden: höchstens drei Monate | |||
| Aufheben von *Niveau 2: Das Zertifikat kann nur fortgesetzt werden, wenn die Zertifizierungsstelle die Critical Nonconformity bei einer verschärften Kontrolle beheben kann (siehe § 5.2.2.1). | |||
| *Niveau 3 Zertifikat muss entzogen werden: für mindestens ein Jahr Ausschluss von der Teilnahme am GMP+ Feed Certification scheme sowie von allen Torwächteroptionen. | |||
| Nach GMP+ zertifizierte Unternehmen
| Zertifikat kann nicht erteilt werden | *Niveau 1. Zertifikat muss ausgesetzt werden: höchstens 3 Monate | |
| Aufheben von *Niveau 1: Das Zertifikat kann nur fortgesetzt werden, wenn die Zertifizierungsstelle die Critical Nonconformity bei einer verschärften Kontrolle beheben kann (siehe § 5.2.2.1). | |||
| *Niveau 2. Zertifikat muss entzogen werden: für mindestens ein Jahr Ausschluss von der Teilnahme am GMP+ Feed Certification scheme sowie von allen Torwächteroptionen. | |||
| * Sanktionen können auf jedem Niveau verhängt warden. | |||
Appendix 2: Turnus und Auditzeitaufwand
Turnus
Die Audits müssen gemäß dem folgenden Zyklus ausgeführt werden.
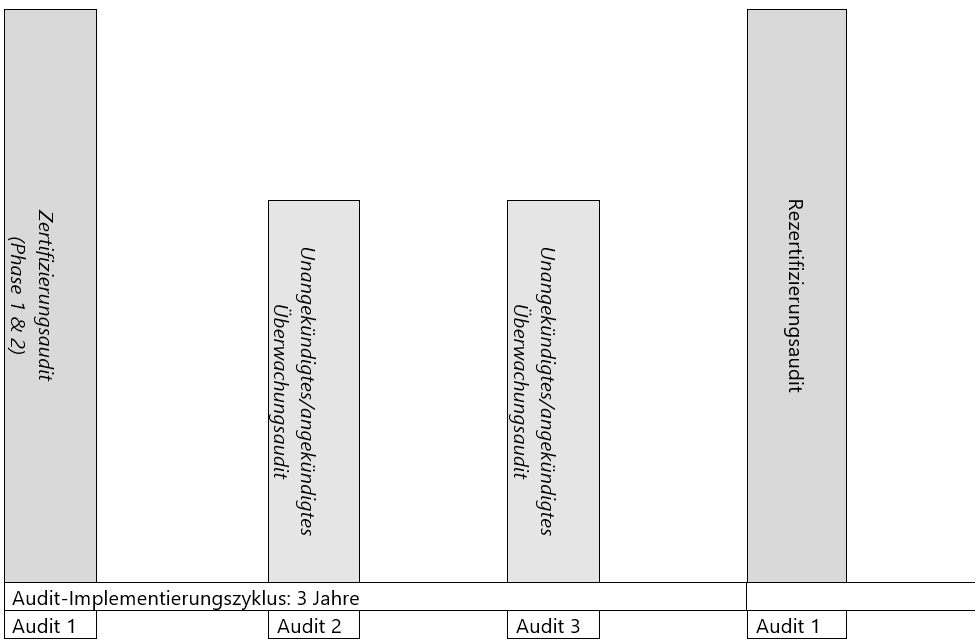
Es handelt sich hier um eine qualitative Wiedergabe des Auditzyklus für die Durchführung von GMP+-Audits.
Der Auditzeitaufwand wird in Tagen dargestellt; ein Tag entspricht acht Stunden. Der Auditzeitaufwand für Audits umfassen Phase 1 & 2 des Erstzertifizierungsaudits. Die Tabellen in diesem Appendix enthalten den verpflichteten Mindestauditzeitaufwand einschließlich Vorbereitung und Berichterstattung zu dem Audit. Der Auditzeitaufwand für Audits vor Ort muss mindestens 70 Prozent des verpflichteten Auditzeitaufwands für alle Audittypen betragen (außer es handelt sich um nicht vor Ort durchgeführte Audits der Phase 1). Sofern dies korrekt dokumentiert und berechtigt ist, kann für eine Organisation mit geringer Komplexität der Mindestauditzeitaufwand reduziert werden; ausschlaggebend dafür sind , ein einfacher Herstellungsprozess, der Umfang der Organisation, das Produktvolumen (einschließlich einer begrenzten Anzahl an Produkten), eine saisonabhängige Aktivität usw. Das nach GMP+ zertifizierte Unternehmen muss ein angepasstes Angebot/einen angepassten Zertifizierungsvertrag erhalten. GMP+ International überprüft und bewertet die Begründung beim jährlichen Zertifizierungsstellenaudit. Die Reduzierung des Auditzeitaufwands muss in der GMP+-Unternehmensdatenbank verarbeitet werden.
Die Zertifizierungsstelle darf den Auditzeitaufwand nicht reduzieren, wenn:
- die Reduzierung mehr als 30 Prozent des Mindestauditzeitaufwands beträgt
- während der Gültigkeitsdauer des GMP+-Zertifikats bereits eine Reduzierung des Auditzeitaufwands besteht und sich keine Änderungen an den Aktivitäten ergeben haben
- bei den letzten drei Audits im nach GMP+ zertifizierten Unternehmen eine Critical Nonconformity festgestellt wurde
- bei den letzten drei Audits im nach GMP+ zertifizierten Unternehmen eine Major Nonconformity mit strukturellem Charakter oder eine Major Nonconformity festgestellt wurde, die zu einer Gefahr für die Futtermittelsicherheit geführt hat
- bei den letzten drei Audits im nach GMP+ zertifizierten Unternehmen 20 oder mehr Minor Nonconformities festgestellt wurden.
- Für ein kombiniertes Audit wird der Auditzeitaufwand abgezogen
- Tabelle 2 des vorliegenden Appendix findet Anwendung
Außerdem kann die Auditzeit für den Auditzeitaufwand aus Appendix 4 des vorliegenden Dokuments nicht reduziert werden.
Die Zertifizierungsstelle kann den Auditzeitaufwand beim Erstzertifizierungsaudit nur reduzieren, wenn die Zertifizierungsstelle nachweisen kann, dass sie das Unternehmen für ein anderes, in diesem Appendix genanntes System oder ein gleichwertiges System zertifiziert hat, das in TS1.2 Beschaffung genannt ist, und sie ihre Entscheidung dokumentiert und begründet. Die Reduzierung des Auditzeitaufwands darf nicht zur Neuberechnung des vorgeschriebenen Mindestauditzeitaufwands verwendet werden, es sei denn, dies geschieht wie vorstehend beschrieben beim Erstzertifizierungsaudit.
Diese vorübergehende Abweichung vom Auditzeitaufwand gilt in folgenden Fällen:
- Es ergeben sich keine Änderungen im Hinblick auf die Tätigkeiten und Organisation des nach GMP+ zertifizierten Unternehmens.
- Im Zusammenhang mit dem Auditzeitaufwand werden keine Änderungen in diesem Appendix vorgenommen.
- Das nach GMP+ zertifizierte Unternehmen wechselt nicht zu einer anderen Zertifizierungsstelle. Wenn das nach GMP+ zertifizierte Unternehmen zu einer neuen Zertifizierungsstelle wechselt, muss die neue Zertifizierungsstelle bewerten, ob der Auditzeitaufwand reduziert werden kann.
Im Falle von Wiederholungsprüfungen und verschärften Kontrollen im Sinne von § 5.2.2. gilt der Auditzeitaufwand, den die Zertifizierungsstelle oder GMP+ International für erforderlich hält. Der Auditzeitaufwand kann sich verlängern, wenn die Zertifizierungsstelle EWS, Beschwerden, Befreiungen, Vorfälle usw. untersuchen muss.
Es gilt folgende Reihenfolge:
- Herstellung von Mischfuttermitteln
- Herstellung von Vormischungen
- Herstellung von Zusatzstoffen
- Herstellung von Einzelfuttermitteln
- Herstellung von Heimtierfuttermitteln
- Handel mit Futtermitteln
- Lagerung und Umschlag von Futtermitteln
- Transport von Futtermitteln
- Befrachtung
Zur Berechnung des verpflichteten Mindestauditzeitaufwands (im Rahmen eines Erstzertifizierungsaudits (ICA), (un)angekündigten Überwachungsaudits (USA/ASA) und Rezertifizierungsaudits (RCA)) für einen (1) Standort wird die nachstehende Formel angewandt:
Ts = TD + TH1 (sofern zutreffend) + TFTE
Erläuterung:
Ts: Mindestauditzeitaufwand
TD: ist die grundlegende Auditzeit in Tagen;
TH1: ist die Anzahl der Audittage für zusätzliche GMP+-Anwendungsbereiche
TFTE: ist die Anzahl der Audittage pro Mitarbeiterzahl.
| Tabelle 1 | |||||
| Mindestzeitaufwand für1: Ts = TD + TH1 (sofern zutreffend) + TFTE | |||||
| | Basisauditzeitaufwand in Tagen | Anzahl Audittage für jeden zusätzlichen GMP+-Anwendungsbereich | Gesamtzahl Mitarbeiter (VZÄ (FTE) 7 betreffend Personal, das im Bereich aller GMP+-Tätigkeiten beschäftigt ist, ausgedrückt in Audittagen) | Abziehbarer GMP+-Auditzeitaufwand bei einem kombinierten Audit mit einer gültigen Version äquivalenter Systeme/Anwendungsbereiche gemäß GMP+ TS1.2 Beschaffung | Abziehbarer Auditzeitaufwand bei einem kombinierten Audit5 |
| GMP+-Anwendungsbereiche | TD | TH1 | TFTE | | |
| Herstellung von Mischfuttermitteln2+3+6 | 1,75 | 0,1875 | 1 bis 19 = 0 20 bis 49 = 0,125 50 bis 79 = 0,25 80 bis 200 = 0,375 >200 = 0,5 | Reduzierung um höchstens 75 % des verpflichteten Mindestauditzeitaufwands. | Reduzierung um höchstens 50 % des verpflichteten Mindestauditzeitaufwands. |
| Herstellung von Vormischungen6 | 1,75 | 0,1875 | |||
| Herstellung von Zusatzstoffen6 | 1,75 | 0,1875 | |||
| Herstellung von Einzelfuttermitteln3+6 | 1,125 | 0,1875 | |||
| Handel mit Futtermitteln3+8+9 | 1,00 | 0,1875 | |||
| Lagerung und Umschlag von Futtermitteln8+9 | 1,00 | 0,1875 | |||
| Transport von Futtermitteln4+8+9 | 1,00 | 0,1875 | |||
| Befrachtung8+9 | 0,70 | nicht Zutreffend | |||
| 1 Gilt für alle Arten von Audits (Sonderaudits nach § 5.2.2 sind ausgeschlossen). 2 Ohne Verwendung kritischer Zusatzstoffe und/oder Tierarzneimittel kann der Auditzeitaufwand um höchstens 0,25 Tage je Standort reduziert werden. 3 Gilt für Heimtierfuttermittel. 4 Bei Straßentransporten ist die Befrachtung des Straßentransports inbegriffen. 5 ISO9001 und/oder SO22000 Anwendungsbereich Futtermittel in Kombination mit ISO22002-6 und/oder IFS Lebensmittel und/oder BRC Herstellung und/oder FSSC 22000 6 Sofern eine Organisation Arbeitnehmer im Schichtdienst einsetzt und die Produkte und/oder Prozesse vergleichbar sind, wird die Zahl der VZÄ (FTE) auf der Grundlage der in der Hauptschicht tätigen Arbeitnehmer (einschließlich Saisonarbeiter und Büropersonal) berechnet. 7 Die Anzahl der Arbeitnehmer umfasst auch Teilzeitarbeitnehmer, die als Anteil von VZÄ (FTE) gerechnet werden. 8 Im Falle einer Rechnungsadresse, beträgt der vorgeschriebene Mindestauditzeitaufwand 0,125 Tage. 9 Im Falle eines Postfachs beträgt der vorgeschriebene Mindestauditzeitaufwand 0,125 Tage. | |||||
| Tabelle 2 | |||||||||||
| Ergänzende Anforderungen an die Berechnung des Auditzeitaufwands | | ||||||||||
| Jeder zusätzlich auditierte Produktionsstandort1 | 1 Tag für alle Audittypen. | ||||||||||
| Jeder zusätzliche Produktionsstandort1, an dem Mischfuttermittel unter Verwendung kritischer Zusatzstoffe und/oder kritische Tierarzneimittel hergestellt werden | 1,25 Tag für alle Audittypen. | ||||||||||
| Handel mit Futtermitteln ≤ 2 TFTE2 | Reduzierung um höchstens 0,1875 Tage pro Audittyp. | ||||||||||
| Handel mit Futtermitteln. „Fouragehandel“ ≤5 Produkte | Reduzierung von höchstens 0,5 Tagen pro Audittyp. | ||||||||||
| Handel an viehhaltende Betriebe | Reduzierung von höchstens 0,75 Tagen pro Audittyp. | ||||||||||
| Lagerung und Umschlag von Futtermitteln, ≤ 5 TFTE2 | Reduzierung um höchstens 0,1875 Tage pro Audittyp. | ||||||||||
| Straßentransport von Futtermitteln, ≤ 2 TFTE2 | Reduzierung um höchstens 0,70 Tage pro Audittyp. | ||||||||||
| Straßentransport von Futtermitteln , 3- 5 TFTE2 | Reduzierung um höchstens 0,40 Tage pro Audittyp. | ||||||||||
| Schienentransport von Futtermitteln | Reduzierung um höchstens 0,30 Tage pro Audittyp. | ||||||||||
| Antibiotikafreier Produktionsstandort (grundsätzlich ergänzend) | 0,25 Tage für alle Audittypen | ||||||||||
| Dioxinüberwachung in Futtermitteln für Legehennen (grundsätzlich ergänzend) | 0,125 Tage für alle Audittypen | ||||||||||
| QM-Milch3 (grundsätzlich ergänzend) | 0,125 Tage für alle Audittypen | ||||||||||
| 1 Anforderungen an einen zusätzlichen Produktionsstandort : Ein Standort, der eine gesetzliche oder vertragliche Beziehung zum nach GMP+ zertifizierten Hauptstandort der Organisation hat und der einem gemeinsamen Managementsystem unterliegt, das vom Hauptstandort festgelegt, erstellt und implementiert wird und fortlaufend Überwachungs- und internen Audits unterzogen wird. Das bedeutet, dass der Hauptstandort das Recht hat, zu fordern, dass die Niederlassungen erforderlichenfalls Korrekturmaßnahmen ergreifen. Gegebenenfalls muss dies in einem formellen Vertrag zwischen dem Hauptstandort und den Niederlassungen festgelegt werden. Für jeden zusätzlichen FSA-Anwendungsbereich müssen 0,1875 Tage hinzugefügt werden. 2 Gilt nur, wenn das Unternehmen für einen einzigen Geltungsbereich zertifiziert ist. Wenn das Unternehmen für mehrere Bereiche zertifiziert ist, gilt die Gesamtzahl der an GMP+-Tätigkeiten beteiligten Vollzeitkräfte. Siehe Beispiel in dem hilfreichen Tipp. 3Zudem kann von dem verpflichteten Mindestaufwand - einschließlich des Erstzertifizierungsaudits (ICA) - abgewichen werden, sofern folgende Voraussetzungen erfüllt sind:
Sofern alle Nachweise zu diesen QM-Milch-Anforderungen am Hauptstandort beurteilt werden können, gilt für den Hauptstandort der zusätzliche Auditzeitaufwand aus der nachstehenden Tabelle.
| |||||||||||
Hilfreicher Tipp
Beispiel: Bei einem Händler mit 1 VZÄ (FTE) und dem ergänzenden Anwendungsbereich Lagerung und Umschlag von Futtermitteln mit 2 VZÄ beläuft sich die Zahl der VZÄ in Bezug auf GMP+-Tätigkeiten auf 3 VZÄ. Infolgedessen erfüllt der Händler nicht die Kriterien für den Handel mit Futtermitteln ≤ 2 TFTE.
| Tabelle 3 | |||||
| „GMP+ FSA“-Modul | Anzahl Analysen | Audit-/Inspektionshäufigkeit | Mindestzeitaufwand für Audits/Inspektionen in Tagen, keine Reduzierung des Auditzeitaufwands gestattet, es sei denn, es gilt eine der Fußnoten. |
| |
|
|
|
| Erstzertifizierungs- oder Rezertifizierungsaudit/-inspektion | Angekündigtes/ unangekündigtes Überwachungsaudit | Bemerkung |
| Anwendungsbereich: Laboruntersuchungen |
|
|
|
|
1 + 2 + 3 |
| Nach ISO/IEC 17025 akkreditiert
| < 5 | 1-mal jährlich | 0,25 | 0,25 | |
| 5 - 15 | 1-mal jährlich | 0,38 | 0,38 | ||
| >15 | 1-mal jährlich | 0,50 | 0,50 | ||
| Teilweise nach ISO/IEC 17025 akkreditiert
| < 5 | 1-mal jährlich | 0,69 | 0,69 | |
| 5 - 15 | 1-mal jährlich | 1,00 | 1,00 | ||
| >15 | 1-mal jährlich | 1,19 | 1,19 | ||
| Nicht nach ISO/IEC 17025 akkreditiert |
|
|
|
| |
| Hauptstandort (einschl. System) | < 5 | 1-mal jährlich | 1,00 + 1,00 | 0,81 + 0,81 | |
| 5 - 20 | 1-mal jährlich | 1,19 + 1,19 | 1,19 + 1,19 | ||
| >20 | 1-mal jährlich | 1,50 + 1,50 | 1,19 + 1,19 | ||
| Sekundärer Standort (Analysen) | < 5 | 1-mal jährlich | 0,63 | 0,69 | |
| 6 - 20 | 1-mal jährlich | 0,81 | 0,94 | ||
| >20 | 1-mal jährlich | 1,00 | 1,19 | ||
| Anwendungsbereich: Registriertes Labor |
|
|
|
|
|
| das alle Analysen auslagert |
| 1-mal jährlich | 0,50 | 0,50 | 4 |
| das Analysen teilweise auslagert |
| 1-mal jährlich | 1,006 | 1,006 | 4 + 5 |
| Ohne Vergabe jeglicher Analysen |
| 1-mal jährlich | 1,006 | 1,006 | 5 |
| Anwendungsbereich: Küsten- und Binnenschifffahrtstransport von Futtermitteln |
| 1-mal in 2 Jahren | 0,25 | n. zutr. |
|
| 1 Labortypen: - Falls das Labor für mehr als 50 Analysen nach ISO/IEC 17025 akkreditiert ist, kann der Mindestzeitaufwand um 0,094 Tage erhöht werden. - Sofern das Labor nicht nach ISO 17025 akkreditiert ist, besuchen sowohl der Materialexperte als auch der Auditor das Labor zur Systembewertung. 2 Wenn ein Labor sowohl nach GMP+ TS4.1 Laboruntersuchungen als auch ISO 9001:2000 oder ISO 22000 zertifiziert ist, darf unter der Voraussetzung, dass das Labor über das entsprechende ISO-Zertifikat oder die entsprechenden ISO-Zertifikate verfügt, eine Reduzierung des Auditzeitaufwands um 35 Prozent angewandt werden. Die Reduzierung des Auditzeitaufwands darf nur angewandt werden, sofern alle Nebenstandorte unter dem QM-System des Hauptstandorts arbeiten. Die Systemvoraussetzungen und Analysen werden am Hauptstandort bewertet. An den Nebenstandorten werden nur die Analysen bewertet. 3 Die Anforderungen zum Anwendungsbereich Laboruntersuchungen und anderer GMP+-Anwendungsbereiche weichen derart voneinander ab, dass ein kombiniertes Audit für den Anwendungsbereich Laboruntersuchungen und einen oder mehr der anderen GMP+-Anwendungsbereiche zu keiner Reduzierung des Auditzeitaufwands führt. 4 Die Auditzeitaufwände gelten für die Bewertung einer Analyse. Für die Bewertung jeder ausgelagerten weiteren Analyse müssen 0,5 Stunden hinzugezählt werden. 5 Die Auditzeitaufwände gelten für die Bewertung einer Analyse. Für die Bewertung jeder ausgelagerten weiteren Analyse müssen 2,0 Stunden hinzugefügt werden. 6 Der Auditzeitaufwand für die Auditierung von TS 4.2 Registrierte Labore kann bis 50 Prozent reduziert werden, sofern die Bewertung in Kombination mit dem Anwendungsbereich Laboruntersuchungen durchgeführt wird. Der Auditzeitaufwand für die Auditierung von TS 4.2 Registrierte Labore kann bis 50 Prozent reduziert werden, sofern das Unternehmen für ISO/IEC 17025 akkreditiert ist. | |||||
| Zusätzlicher Auditzeitaufwand in Tagen für die Bewertung von Torwächterdossiers | |||
| Anzahl der Torwächterdossiers | Mindestzahl Dossiers, die alle 3 Jahre bewertet werden müssen | TS1.2: 4.3.4 Beschaffung ehemaliger Lebensmittel 4.3.6. Beschaffung von Einzelfuttermitteln mineralischen Ursprungs 4.3.7 Beschaffung bearbeiteter Einzelfuttermittel | TS1.2: 4.3.2 Beschaffung von unbearbeiteten Getreiden, (Öl-)Saat und Hülsenfrüchten aus einer Erfassungskette 4.3.5 Beschaffung von Palmöl 4.3.8 Beschaffung von Futtermitteln für Futtermittelversuche 4.4.1 Beschaffung von Straßentransporten 4.4.2 Beschaffung von Binnenschifffahrtstransporten 4.4.3 Beschaffung von Lagerung und Umschlag 4.5.2 Ausgangserzeugnis für die Soapstock-Spaltung |
| 1 bis 5 | Alles | 0,125 pro Dossier | 0,063 pro Dossier |
| 6 bis 10 | 5 | 0,125 pro Dossier | 0,063 pro Dossier |
| 11 bis 15 | 6 | 0,125 pro Dossier | 0,063 pro Dossier |
| 16 bis 30 | 7 | 0,125 pro Dossier | 0,063 pro Dossier |
| 31 bis 50 | 8 | 0,125 pro Dossier | 0,063 pro Dossier |
| 51 bis 100 | 9 | 0,125 pro Dossier | 0,063 pro Dossier |
| >100 | 10 | 0,125 pro Dossier | 0,063 pro Dossier |
Appendix 3: Berichtsmuster oder Auditbericht/Inspektionscheckliste
Berichtsmuster A:
1 Allgemeine Angaben
Angaben zum Hauptstandort :
Name des nach GMP+ zertifizierten Unternehmens :
Anschrift :
Postleitzahl und Ort :
Telefon :
E-Mail :
GMP+-Registriernummer :
Gesetzliche Registriernummer des Unternehmens :
Kontaktperson :
Gesprochen mit:
| Bezeichnung | Position |
| | |
| | |
Die Bewertung wird gemäß GMP+ Feed Certification scheme 2020 durchgeführt.
Übersicht über alle Betriebsstandorte (einschl. Hauptstandort) und GMP+-Anwendungsbereiche
| GMP+-Registriernummer | Bezeichnung des Standorts | Adresse Postleitzahl Ort, Land | Geltende GMP+-Anwendungsbereiche | Ablaufdatum des aktuellen Zertifikats oder der befristeten Zulassung: |
| | | | | |
| | | | | |
Liste von Standorten im Falle einer Matrixzertifizierung (sofern zutreffend)
| GMP+-Registriernummer Standort | Bezeichnung des Standorts | Adresse Postleitzahl Ort, Land | Geltende GMP+-Anwendungsbereiche | Auditdatum |
| | | | | |
Angaben zum Audit:
□ Erstzertifizierungsaudit - vor Ort
□ Erstzertifizierungsaudit - vollständiges Fernaudit
□ Erstzertifizierungsaudit - Begleitetes Fernaudit
□ Angekündigtes Überwachungsaudit - vor Ort
□ Angekündigtes Überwachungsaudit - vollständiges Fernaudit
□ Angekündigtes Überwachungsaudit - Begleitetes Fernaudit
□ Unangekündigtes Überwachungsaudit - vor Ort
□ Unangekündigtes Überwachungsaudit - vollständiges Fernaudit
□ Unangekündigtes Überwachungsaudit - Begleitetes Fernaudit
□ Rezertifizierungsaudit - vor Ort
□ Rezertifizierungsaudit - vollständiges Fernaudit
□ Rezertifizierungsaudit - Begleitetes Fernaudit
□ Zusatzaudit - vor Ort
□ Zusatzaudit - vollständiges Fernaudit
□ Zusatzaudit - Begleitetes Fernaudit
□ Wiederholungsaudit
□ Verschärfte Kontrolle
□ Dokumentenbewertung (im Falle einer befristeten Zulassung)
□ Audit-/Inspektions*zeitaufwand (in Tagen)
□ Kombi-Audit ja/nein anwendbares QM-System
□ Sonstiges
Datum der Dokumentenprüfung :
Auditdatum :
Berichtsdatum :
Vertreter des nach GMP+ zertifizierten Unternehmens einschließlich Name und Position :
Dokumente bewertet :
Zertifizierungsstelle :
(Lead-)Auditor(en) :
Midauditor 1 :
Midauditor 2 :
Technische(r) Sachkundige(r) :
Führer :
Name __________________________ Unterschrift (Auditor) _________________________
2 Anwendungsbereich nach GMP+ zertifiziertes Unternehmen/Standorte
Spezifizieren Sie den Typ des nach GMP+ zertifizierten Unternehmens und seine Tätigkeiten. Beschreiben Sie die Erzeugnisse und Volumen. Geben Sie den Status (fest angestellt oder ausgeliehen) und die Zahl der Mitarbeiter pro Standort an. Beschreiben Sie die Organisationsstruktur. Geben Sie auch andere Unternehmen am selben Standort oder unter derselben Holding (mit vergleichbaren Namen oder inkompatiblen Tätigkeiten) an. Fassen Sie den gesamten Prozess und die Dokumentation des Managementsystems kurz zusammen, beispielsweise Beschaffung, Herstellungsprozess, Lagerung, Verkauf und Transport von Haupt- und Nebenproduktströmen (vor allem im Zusammenhang mit den Tätigkeiten, auf die sich der Antrag bezieht). Geben Sie auch an, ob das nach GMP+ zertifizierte Unternehmen das Torwächterprinzip anwendet, und beschreiben Sie die Tätigkeiten.
3 Auditziele
Die Auditziele müssen beschreiben, was mit dem Audit bewirkt werden soll, und Folgendes enthalten:
- Bestimmung der Konformität des Feed safety management system des Kunden oder Teilen davon, einschließlich der Auditkriterien
- Evaluierung der Wirksamkeit des QM-Systems, um zu gewährleisten, dass die Organisation des nach GMP+ zertifizierten Unternehmens die geltenden gesetzlichen, vorschriftsmäßigen und vertraglichen Anforderungen erfüllt.
- Evaluierung der Wirksamkeit des QM-Systems, um zu gewährleisten, dass die Organisation des nach GMP+ zertifizierten Unternehmens dauerhaft die gesetzten Ziele erreicht.
- Sofern zutreffend, Kennzeichnung von Bereichen des Managementsystems, die eventuell verbesserungsbedürftig sind.
4 Abweichung vom Auditplan/entscheidende Fragen, die Einfluss auf das Auditprogramm haben.
Der Grund für die Abweichung und wichtige Elemente, die Einfluss auf das Auditprogramm haben, müssen angegeben werden.
5 Welche Elemente wurden bewertet und welche Schlussfolgerungen wurden daraus gezogen?
Im Allgemeinen muss aus dem Bericht deutlich hervorgehen, was bewertet wurde und welche Schlussfolgerung der Auditor gezogen hat. Verifizierung der Wirksamkeit der getroffenen Korrekturmaßnahmen im Hinblick auf die zuvor festgestellten Nonconformities, sofern zutreffend. Für jedes Auditziel muss eine Schlussfolgerung angegeben werden.
6 Zusammenfassung der Bewertung und eine allgemeine Schlussfolgerung
Beginnen Sie mit einem Standardsatz wie „Das Audit beim nach GMP+ zertifizierten Unternehmen fand im Rahmen eines Überwachungsaudits zur Überprüfung der GMP+-Anforderungen statt. Beim nach GMP+ zertifizierten Unternehmen wurden die Anforderungen der geltenden GMP+-Anwendungsbereiche bewertet.“
Geben Sie an, ob die beim vorherigen Audit festgestellten Nonconformities behoben wurden.
Erstellen Sie eine Zusammenfassung pro Standort sowie eine Gesamtzusammenfassung.
Fassen Sie den allgemeinen Eindruck, den Sie vom QM-System des nach GMP+ zertifizierten Unternehmens haben, kurz zusammen.
Eventueller Nachtrag nach einer definitiven Bewertung durch den Technical Reviewer: Berichtsprüfung von ergänzenden Dokumenten und Folgemaßnahmen.
| Anzahl der beim Audit festgestellten Nonconformities | |||||||||
| Standort | Beim vorherigen Audit | Während des Audits | Bei Endbewertung | ||||||
| | Zahl der Audit-Nonconformities | Zahl der Audit-Nonconformities | Zahl der Audit-Nonconformities | ||||||
| | Critical | Major | Minor | Critical | Major | Minor | Critical | Major | Minor |
| | | | | | | | | | |
Auditschlussfolgerung: Das nach GMP+ zertifizierte Unternehmen erfüllt/erfüllt nicht die Anforderungen des GMP+-Moduls.
Maßnahmen und Sanktionen: Conformity Audit, Wiederholungsprüfung, verschärfte Kontrolle (einschl. Frist), Aussetzung, Entzug.
7 Appendizes
Verwendete Checklisten, Berichtsformulare für Audit-Nonconformities.
Hinweis: Festgestellte Nonconformities müssen auch in der englischen/deutschen oder niederländischen Sprache erfasst werden.
Berichtsmuster B:
Auditbericht/Inspektionscheckliste*
(Dieses Muster vermittelt einen Eindruck vom Auditbericht bzw. der Inspektionscheckliste*. Die aktuelle Version des Auditberichts bzw. der Inspektionscheckliste* finden Sie immer in der GMP+-Datenbank/Audit-App)
| Zertifizierungsstelle | |
| Zertifizierungsstelle | |
| Angaben zum Unternehmen | |||
| GMP+-Registriernummer | | ||
| Firmenname | | ||
| Kontaktperson im Unternehmen | | ||
| Adresse des Unternehmens | | ||
| Postanschrift | | ||
| Gesetzliche Registriernummer des Unternehmens. | | ||
| Rund um die Uhr erreichbare Telefonnummer | | ||
| E-Mail-Adresse | | ||
| Gesprochen mit, Name und Position | | ||
| Torwächterdossiers | | Anzahl Torwächterdossiers - TS1.2 4.3.3 Beschaffung von Zusatzstoffen, Lebensmitteln, Arzneimitteln, Kräutern und Gewürzen 4.3.4 Beschaffung ehemaliger Lebensmittel 4.3.6 Beschaffung von Einzelfuttermitteln mineralischen Ursprungs 4.5.1. Andere Produkte und Dienstleistungen | |
| | | Anzahl Torwächterdossiers - TS1.2 4.3.1 Beschaffung unbearbeiteter Agrarerzeugnisse vom landwirtschaftlichen Erzeuger zur Verwendung in oder als Futtermittel 4.3.2 Beschaffung von unbearbeiteten Getreiden, (Öl-)Saat und Hülsenfrüchten aus einer Erfassungskette 4.3.5 Beschaffung von Palmöl 4.3.7. Beschaffung von bearbeiteten Einzelfuttermitteln 4.3.8 Beschaffung von Futtermitteln für Futtermittelversuche 4.4.1 - Beschaffung von Straßentransporten 4.4.2 Beschaffung von Binnenschifffahrtstransporten 4.4.3 Beschaffung von Lagerung und Umschlag 4.5.2 Ausgangserzeugnis für die Soapstock-Spaltung | |
| Zahl der VZÄs | | ||
| Name des Schiffes | | ||
| Schiffseigner | | ||
| Registriernummer des Schiffs/EU-Nummer | | ||
| Schiffsgröße in Tonnen | | ||
| Kubikinhalt, gesamt | | ||
| Zahl der Frachträume | | ||
| Art des Lukendeckels | | ||
| Bodenart (Stahl, Holz) | | ||
| Zertifizierung | ||||
| Anwendungsbereich | Modul | Zertifiziert seit | Anfangsdatum | Ablaufdatum |
| | | | | |
| Geschäftsbeziehung | |
| Verbunden mit | Geschäftsbeziehung |
| Audit-/Inspektions daten | |
| Audit/Inspektions datum | |
| Datum des Berichts | |
| Zertifizierungsstelle | |
| Zertifizierungsstelle - GMP+-Registriernummer | |
| (Lead-)Auditor/Inspektor | |
| Führer | |
| Mitauditor 1 | |
| Mitauditor 2 | |
| Leitender Begutachter | |
| Beobachter | |
| Technischer/Materialsachverständiger | |
| Aus der Ferne | Ja/Nein methode |
| Audit/Inspektions typ | |
| Audit-/Inspektions zeitaufwand (in Tagen) | |
| Kombiniertes Audit | |
| Zertifikat des Kombisystems | Ja/Nein Gültigkeit |
* Initial Certification audit (ICA) Surveillance audit (SA) Unannounced Surveillance audit (USA) Recertification audit (RCA), Compliance audit (CA), Stricter Supervision audit (SSA), Repeat audit (RPA), Document assessment (DA)
| Anwendungsbereiche und Module des Audits | |
| | |
Auditziele
| Die Auditziele müssen beschreiben, was mit dem Audit bewirkt werden soll, und Folgendes enthalten: a) Bestimmung der Konformität des Feed safety management system des Kunden oder Teilen davon, einschließlich der Auditkriterien b) Evaluierung der Wirksamkeit des QM-Systems, um zu gewährleisten, dass die Organisation des nach GMP+ zertifizierten Unternehmens die geltenden gesetzlichen, vorschriftsmäßigen und vertraglichen Anforderungen erfüllt c) Evaluierung der Wirksamkeit des QM-Systems, um zu gewährleisten, dass die Organisation des nach GMP+ zertifizierten Unternehmens dauerhaft die gesetzten Ziele erfüllt d) Sofern zutreffend, Kennzeichnung von Bereichen des Managementsystems, die eventuell verbesserungsbedürftig sind. |
Abweichung vom Auditplan/entscheidende Fragen, die Einfluss auf das Auditprogramm haben.
Grund für die Abweichung, der angegeben werden muss, und entscheidende Fragen, die Einfluss auf das Auditprogramm haben.
Allgemeine Informationen
Nach GMP+ zertifiziertes Unternehmen/Standort
| Die definierten Prozesse und die Dokumentation des Managementsystems, das vom nach GMP+ zertifizierten Unternehmen/der antragstellenden Organisation entwickelt wurde. |
| Auditanforderungen | ||||
| Art.-Nr. | Anwendungsbereich | Modul | Auditfrage | Einhaltung |
Verifizierung der Wirksamkeit der getroffenen Korrekturmaßnahmen im Hinblick auf die zuvor festgestellten Nonconformities, sofern zutreffend.
Weitere bewertete Elemente
| Nonconformities aus vorherigem Audit |
| |
| Nonconformities aus aktuellem Audit |
Auditergebnis
| Datum, Ort | Unterschrift Auditor |
| | |
| Datum, Ort | Unterschrift leitender Begutachter |
| | |
| Datum, Ort | Unterschrift Kunde |
Anhang zum Bericht NCR-Formular Ja/Nein
Appendix 4A: Matrixzertifizierung
Die Matrixzertifizierung ist möglich:
- bei einem nach GMP+ zertifizierten Unternehmen mit einem Hauptstandort mit 100%igen Tochterunternehmen, oder
- bei einer Gruppe von Unternehmen, die sich zu einer Qualitätsgemeinschaft zusammengeschlossen haben
Bei einer Matrixzertifizierungsorganisation braucht es sich nicht um eine individuelle juristische Person zu handeln, aber alle Matrixzertifizierungsstandorte müssen über eine juristische oder vertragliche Verbindung zum Hauptstandort der Matrixzertifizierungsorganisation verfügen und einem gemeinsamen Managementsystem unterworfen sein, das vom Hauptstandort erstellt, festgestellt und über eine ständige angekündigte Kontrolle und interne Audits beaufsichtigt wird. Das bedeutet, dass der Hauptstandort das Recht hat, von den Niederlassungen zu fordern, dass sie bei Bedarf Korrekturmaßnahmen ergreifen, wenn das an einem Standort erforderlich ist. Gegebenenfalls muss dies in einem formellen Vertrag zwischen dem Hauptstandort und den Matrixzertifizierungsstandorten festgelegt werden.
Matrixzertifizierung darf nicht angewendet werden, wenn sich verschiedene selbstständige Unternehmen in einem Branchenverband, einer Gewerkschaft, einer Föderation, einer Vereinigung oder über ein unabhängiges Beratungsbüro o.dgl. zusammengeschlossen haben.
Matrixzertifizierung ist nicht gestattet für die FSA-Anwendungsbereiche (einschließlich der Country Notes) von:
- Herstellung von Mischfuttermitteln
- Herstellung von Vormischungen
- Herstellung von Einzelfuttermitteln
- Herstellung von Zusatzstoffen.
- Laboruntersuchungen;
- Registriertes Labor;
- Küsten- und Binnenschifffahrtstransport von Futtermitteln.
Matrixzertifizierung ist gestattet für alle FSA-Anwendungsbereiche (einschl. Country Notes) von:
- Handel mit Futtermitteln
- Lagerung und Umschlag von Futtermitteln
- Transport von Futtermitteln
- Befrachtung
Hilfreicher Tipp
Wenn eine Gruppe beispielsweise aus mehreren Produktionsstandorten und Lagerstandorten besteht, können die Produktionsstandorte in dieser Gruppe nicht nach der Matrixzertifizierungsregelung zertifiziert werden; bei den Lagerstandorten ist dies jedoch schon möglich.
1. Allgemeine Anforderungen
- Die Matrixzertifizierungsorganisation fällt unter dasselbe QM-System, das vom Hauptstandort gelenkt wird. Dieses QM-System genügt dem/den zutreffenden GMP+-Anwendungsbereich(en), und an sämtlichen Matrixzertifizierungsstandorten müssen die zutreffenden GMP+-Anforderungen erfüllt werden (siehe auch den Benutzertipp unter Zertifizierung).
- In der Matrixzertifizierungsorganisation werden dieselben Methoden und Verfahren angewendet.
- Vom Hauptstandort aus können Korrekturmaßnahmen für sämtliche Standorte angeordnet werden.
- Zwischen den Matrixzertifizierungsstandorten und dem Hauptstandort muss ein schriftlicher Vertrag festgelegt werden. Dieser Vertrag muss von allen beteiligten Parteien unterzeichnet werden, und der unterzeichnete Vertrag muss am Hauptstandort vorliegen und dem Auditor zur Verfügung gestellt werden können. Der Vertrag muss mindestens Folgendes enthalten:
- eine Verpflichtung des Nebenstandorts gegenüber dem Hauptstandort, dass die im QM-System enthaltenen Anforderungen erfüllt werden
- dass die vom Hauptstandort vorgegebenen Korrekturmaßnahmen verbindlich sind
- dass das Vorstehende für alle Tätigkeiten im Zusammenhang mit Futtermitteln gilt (also auch für die, die mehr oder weniger selbstständig durchgeführt werden).
- Sämtliche Matrixzertifizierungsstandorte sind in das interne Auditprogramm aufgenommen worden. Das interne Audit muss einmal im Jahr an allen Matrixzertifizierungsstandorten durchgeführt werden.
- Der Hauptstandort muss nachweisen, dass er in der Lage ist, die Daten jedes Matrixzertifizierungsstandorts zu erfassen, zu analysieren und erforderlichenfalls Änderungen zu implementieren im Hinblick auf:
1. Systemdokumente und Änderungen
2. Managementbewertung
3. Bearbeitung von Beanstandungen
4. Korrekturmaßnahmen
5. die Planung interner Audits und Korrekturmaßnahmen.
- Bei unbearbeiteten Produkten müssen alle Matrixzertifizierungsstandorte im selben Land oder in den angrenzenden Regionen der Nachbarländer liegen.
1.1 Zertifizierung
Bevor ein Erstzertifizierungsaudit stattfinden kann, muss ein individueller Zertifizierungsvertrag/Musterzertifizierungsvertrag, der den Hauptstandort und die Matrixzertifizierungsstandorte umfasst, abgeschlossen werden; darüber hinaus muss auch der interne Auditbericht verfügbar sein, damit er der Zertifizierungsstelle zur Bewertung vorgelegt werden kann.
Hilfreicher Tipp
Wenn der Hauptstandort für einen Herstellungsanwendungsbereich zertifiziert ist und die Matrixzertifizierungsstandorte für einen Transport- und/oder Handelsanwendungsbereich zertifiziert sind, dann muss der Hauptstandort auch für diesen Anwendungsbereich (Transport und/oder Handel) zertifiziert werden, da die Lenkung und die Kontrolle des Feed safety management system zentral vom Hauptstandort aus erfolgen.
Auditturnus für eine Organisation mit Matrixzertifizierung:
- Bei Organisationen mit einem Hauptstandort und mindestens 20 Matrixzertifizierungsstandorten müssen sämtliche Matrixzertifizierungsstandorte mindestens einmal während eines Zertifizierungszyklus auditiert werden.
- Bei Organisationen mit einem Hauptstandort und mehr als 20 Matrixzertifizierungsstandorten müssen sämtliche Matrixzertifizierungsstandorte mindestens einmal während zwei einander folgenden Zertifizierungszyklen auditiert werden.
Der Hauptstandort muss im Jahresrhythmus vor Ort auditiert werden.
Sofern einer Organisation mit Matrixzertifizierung ein neuer Matrixzertifizierungsstandort beitritt (nicht während eines regulären Audits), muss die Bewertung der zutreffenden Elemente am Hauptstandort erfolgen; dies kann über ein Fernaudit erfolgen. Der neue Matrixzertifizierungsstandort muss während des laufenden Zertifizierungszyklus auditiert werden. Sofern die Anforderungen für Appendix 5 und/oder Appendix 6 erfüllt sind, können diese Appendixe angewandt werden.
Verpflichteter Mindestauditzeitaufwand in Tagen pro Matrixzertifizierungsstandort
| Standort | Anzahl FSA-Mitarbeiter*/Produkte | Mindestzeitaufwand je FSA-Audit |
| Hauptstandort | Der Auditzeitaufwand gemäß Appendix 2 wird um einen zusätzlichen Auditzeitaufwand je Matrixzertifizierungsstandort von 0,25 Tagen bis höchstens 1,25 Tage erhöht. | |
| Matrixzertifizierungsstandort Handel mit Futtermitteln | ≤5 Erzeugnisse 6-15 Erzeugnisse >15 Erzeugnisse | 0,25 0,375 0,50 |
| Matrixzertifizierungsstandort Lagerung und Umschlag von Futtermitteln | | 0,25 |
| Matrixzertifizierungsstandort Straßentransport von Futtermitteln | ≤5 VZÄ (FTE)2 6-15 VZÄ (FTE)2 >15 VZÄ (FTE)2 | 0,25 0,375 0,50 |
| Multi-Site-Standort Straßentransport von Futtermitteln, Traktionsunternehmen | | 0,125 |
| Matrixzertifizierungsstandort | | 0,25 |
| Matrixzertifizierungsstandort mit sowohl Lagerung und Umschlag von Futtermitteln als auch Straßentransport von Futtermitteln | ≤5 Erzeugnisse 6-15 Erzeugnisse >15 Erzeugnisse | 0,25 0,375 0,50 |
| Matrixzertifizierungsstandort mit Lagerung und Umschlag von Futtermitteln und/oder Straßentransport von Futtermitteln und/oder Handel mit Futtermitteln | | 0,50 |
| Matrixzertifizierungsstandort - Postfach | | 0,125 |
| Matrixzertifizierungsstandort - Rechnungsadresse | | 0,125 |
| 1 Wenn es sich bei dem Matrixzertifizierungsstandort um einen Vermieter von Zugmaschinen mit Fahrer handelt, gelten 0,125 Tage bis zu einem Maximum von 0,625 Tagen. 2 Mit der Mitarbeiterzahl ist die Gesamtzahl der Arbeitnehmer (einschließlich Teilzeitmitarbeiter als VZÄ-Anteil) je auditiertem Matrixzertifizierungsstandort gemeint. 3 Wenn es sich bei dem Mehrfachstandort um ein Postfach und/oder eine Rechnungsadresse handelt, entfällt die zusätzliche Prüfungszeit in der Hauptgeschäftsstelle. | ||
1.2 Zusatzanforderungen
Ein Transportunternehmen / eine Zugmaschine kann nur unter Matrixzertifizierungsanforderungen zertifiziert werden, wenn das Transportunternehmen / die Zugmaschine den gesamten nach GMP+ gesicherten Futtermitteltransport ausschließlich für den Hauptstandort durchführt. Wenn das nicht der Fall ist, muss das Transportunternehmen / die Zugmaschine separat zertifiziert werden.
Appendix 4B: Matrixzertifizierung für Handel an viehhaltende Betriebe
TS 3.1 Handel an viehhaltende Betriebe
Unternehmen, die TS3.1 anwenden und die zusätzliche Lagerstandorte und/oder Verkaufsstellen oder Verkaufsoutlets haben, dürfen diese Option für die Matrixzertifizierung nutzen.
Es wird zwischen zwei Typen von Vertriebszentren (VZ) unterschieden:
- Das VZ tritt als einziger Lieferant der Zwischenhändler auf. In diesem Fall kann das VZ als Bestandteil der Verkaufsstellen betrachtet werden und fällt daher unter die Zertifizierung für TS3.1. Matrixzertifizierung ist möglich.
- Das VZ ist einer der Lieferanten der Zwischenhändler. Das VZ handelt wesentlich unabhängiger gegenüber den Zwischenhändlern (und umgekehrt) als unter a. In diesem Fall wird das VZ als ein „normaler“ Händler erachtet und muss für den Anwendungsbereich „Handel mit Futtermitteln“ zertifiziert werden. Eine Matrixzertifizierung ist nicht möglich.
1. Allgemeine Anforderungen
Um für eine Matrixzertifizierung gemäß TS 3.1 Handel an viehhaltende Betriebein Betracht zu kommen, muss die Matrixzertifizierungsorganisation folgende Kriterien erfüllen:
- Die Matrixzertifizierungsorganisation hat einen Hauptstandort, von dem aus Tätigkeiten geplant und gelenkt werden.
- Die Matrixzertifizierungsorganisation verfügt über ein Netzwerk aus Lagerstandorten und/oder Verkaufsstellen.
- Alle Lagerstandorte und/oder Verkaufsstellen fallen unter dasselbe QM-System, das vom Hauptstandort aus gelenkt wird. Dieses QM-System muss auf dem/den GMP+-Anwendungsbereich(en) basieren, und sämtliche Matrixzertifizierungsstandorte müssen die GMP+-Anforderungen erfüllen.
- An sämtlichen Matrixzertifizierungsstandorten wird nach denselben Methoden und Verfahren gearbeitet.
- Sämtliche Matrixzertifizierungsstandorte sind in das interne Auditprogramm aufgenommen worden.
- Vom Hauptstandort aus können Korrekturmaßnahmen für sämtliche Lagerstandorte und/oder Verkaufsstellen angeordnet werden.
- Der Hauptstandort muss nachweisen, dass er in der Lage ist, die Daten Matrixzertifizierungsstandorts zu erfassen, zu analysieren und erforderlichenfalls zu ändern im Hinblick auf:
1. Systemdokumente und Änderungen
2. Bearbeitung von Beanstandungen
3. Korrekturmaßnahmen
4. Planung interner Audits und Korrekturmaßnahmen.
- Wenn der Hauptstandort nicht Eigentümer der zusätzlichen Lagerstandorte und/oder Verkaufsstellen ist, muss der Hauptstandort über einen schriftlichen Vertrag mit den Matrixzertifizierungsstandorten (Lagerstandorte und/oder Verkaufsstellen) verfügen, in dem sie Folgendes erklären:
- Die nach GMP+ zertifizierten Futtermittel werden direkt an die Viehhalter verkauft. Der Verkauf an andere nach GMP+ zertifizierte Unternehmen ist nicht gestattet.
- Die Beschaffung von nach GMP+ zertifizierten Futtermitteln findet ausschließlich über den Hauptstandort statt.
- Es wird an allen Tätigkeiten des Hauptstandorts mitgewirkt, die in den vorstehenden Punkten dieser Option beschrieben sind.
Dieser Vertrag muss von allen Zwischenhändlern unterzeichnet werden, die sich an dieser Matrixzertifizierung beteiligen; außerdem muss der unterzeichnete Vertrag am Hauptstandort vorhanden sein und dem Auditor zur Bewertung vorgelegt werden können.
Darüber hinaus müssen alle Matrixzertifizierungsstandorte, die einen Vertrag unterzeichnet haben, bei der Zertifizierungsstelle bekannt sein. Auf der Grundlage dieser Daten kann der Umfang der Stichprobe festgelegt werden.
1.1 Zertifizierung
Bei einer Matrixzertifizierung für TS 3.1 kann der Auditturnus für die zusätzlichen Lagerstandorte oder Verkaufsstellen (mit Ausnahme des Hauptstandorts) gemäß dem folgenden Schema reduziert werden.
| Erstzertifizierungsaudit/Rezertifizierungsaudit/angekündigtes/unangekündigtes Überwachungsaudit | |||
| Zahl der Matrixzertifizierungsstandorte/ | 1 | 2 | > 3 |
| Anzahl der zu auditierenden Matrixzertifizierungsstandorte | 100 %/3 Jahre | 100 %/3 Jahre | 33 %/3 Jahre |
Mindestauditzeitaufwand je Audit in Tagen:
| | Mindestauditzeitaufwand je Audit |
| Zusätzlicher Lagerstandort | 0,125 |
| Zusätzliche Verkaufsstelle | 0,188 |
Da alle Lager- und/oder Verkaufsstellen gemäß denselben Methoden und Verfahren und demselben QM-System vorgehen müssen, kann sich die Bewertung der Dokumentation auf die Verifizierung des Vorhandenseins einer aktuellen Dokumentation und der Vollständigkeit der Dokumentation im Zusammenhang mit dem Matrixzertifizierungsstandort beschränken.
Appendix 5: Audits an einem anderen Standort
Definition:
Siehe F0.2 Definitionsverzeichnis.
Straßentransport von Futtermitteln:
Für den Anwendungsbereich Straßentransport von Futtermitteln kann ein angekündigtes Überwachungsaudit und Rezertifizierungsaudit auch an einem anderen Standort als dem eingetragenen Sitz des nach GMP+ zertifizierten Unternehmens stattfinden.Wenn ein Unternehmen als Hauptstandort für eine Matrixzertifizierungskonstruktion fungiert, ist das Fernaudit nicht gestattet.
Dabei gelten folgende Anforderungen:
- Das nach GMP+ zertifizierte Unternehmen fällt in die Kategorie: 1-5 VZÄ (FTE)
- Das nach GMP+ zertifizierte Unternehmen hat keinen eigenen Arbeitsraum.
- Es ist von keinen Änderungen am Standort und/oder von Tätigkeiten des Unternehmens die Rede.
- Das nach GMP+ zertifizierte Unternehmen bietet mindestens einen Frachtraum, der für den GMP+-Transport verwendet wird (Anhänger/Auflieger usw.), zur Kontrolle an.
e. Der alternative Standort ist für die Durchführung von Audits geeignet:
- Die Kontrolle der Frachträume verursacht keine gefährlichen Situationen für die Betroffenen und Umstehenden.
- Wenn eine kollektive Kontrolle stattfindet (mehrere Unternehmen werden gleichzeitig zu einem Audit eingeladen), dann muss gewährleistet sein, dass die Daten der einzelnen Unternehmen geschützt sind.
Straßentransport von Futtermitteln verpflichteter Sub-Anwendungsbereich Traktionsunternehmen:
Für den Bereich Straßentransport Futtermittel, Traktionsunternehmen können das Erstzertifizierungsaudit, das angekündigte Zwischenaudit und das Rezertifizierungsaudit auch an einem anderen Ort als dem Geschäftssitz des GMP+ zertifizierten Unternehmens stattfinden.
- Hier gelten die folgenden Bedingungen:
- Es gibt keine Änderungen in Bezug auf den Standort und/oder die Aktivitäten des Unternehmens.
- Der alternative Standort ist für die Durchführung von Audits geeignet:
- Wenn es sich um eine Sammelprüfung handelt (mehrere Unternehmen werden gleichzeitig zur Prüfung eingeladen), muss die Privatsphäre der einzelnen Unternehmen gewährleistet sein.
Rechnungsadresse:
Für alle Anwendungsbereiche, für die „Rechnungsadresse“ gilt (siehe F0.3 Anwendungsbereiche für die Zertifizierung), dürfen die angekündigten Überwachungsaudits und Rezertifizierungsaudits auch an einem anderen Standort als dem eingetragenen Sitz des nach GMP+ zertifizierten Unternehmens stattfinden.
Dabei gelten folgende Anforderungen:
- Der alternative Standort ist für die Durchführung von Audits geeignet.
- Es gibt keine Änderungen in Bezug auf den Standort und/oder die Tätigkeiten des Unternehmens.
Postfächer:
Für alle Anwendungsbereiche, für die „Postfach“ gilt (siehe F0.3 Anwendungsbereiche für die Zertifizierung), dürfen die Erstzertifizierungsaudits, angekündigten Überwachungsaudits und Rezertifizierungsaudits auch an einem anderen Standort stattfinden. Während des Erstzertifizierungsaudits ist die Zertifizierungsstelle dafür verantwortlich, festzustellen, ob das Postfach der Definition eines Postfachs in der Definitionsliste F0.2 entspricht.
Dabei gelten folgende Anforderungen:
- Der alternative Standort ist für die Durchführung von Audits geeignet.
- Es ist von keinen Änderungen am Standort und/oder von Tätigkeiten des Unternehmens die Rede.
Handel mit Futtermitteltransporten:
Für den geltenden Anwendungsbereich Handel mit Futtermitteln (siehe F0.3 Anwendungsbereiche für die Zertifizierung) darf ein angekündigtes Überwachungsaudit auch an einem anderen Standort als dem eingetragenen Sitz des nach GMP+ zertifizierten Unternehmens stattfinden.
Dabei gelten folgende Anforderungen:
- Der alternative Standort ist für die Durchführung von Audits geeignet.
- Es ist von keinen Änderungen am Standort und/oder von Tätigkeiten des Unternehmens die Rede.
Befrachtung von Futtermitteltransporten:
Für die Bereiche Befrachtung von Binnenschifffahrt, Küstenschifffahrt, Schienenverkehr, Straßentransport und Seetransport können das angekündigte Zwischenaudit und das Rezertifizierungsaudit auch an einem anderen Ort als dem Geschäftssitz des GMP+-zertifizierten Unternehmens stattfinden.
Hierbei gelten die folgenden Bedingungen:
- Der alternative Standort ist für die Durchführung von Audits geeignet.
- Es gibt keine Änderungen in Bezug auf den Standort und/oder die Aktivitäten des Unternehmens.
Appendix 6: Fernaudits
GMP+ International bietet Zertifizierungsstellen die Möglichkeit, Fernaudits (2 Typen) durchzuführen, sofern die nachstehenden Anforderungen erfüllt sind.
Wird ein Audit in Verbindung mit einem FRA-Anwendungsbereich durchgeführt, so gelten die im vorliegenden Appendix genannten Anforderungen.
|
| Vollständiges Fernaudit | Begleitetes Fernaudit | |
| Anwendbarkeit |
|
|
|
| FSA+-Anwendungsbereiche |
|
|
|
| Audittyp |
|
|
|
| Spezifische Anforderungen | Im Vorfeld des Audits muss die Zertifizierungsstelle eine Risikobewertung zu folgenden Risiken, die einen wesentlichen Einfluss auf das Audit haben, durchführen und dokumentieren:
sofern zutreffend, die Erfahrung des letzten Fernaudits. | Dieselben Anforderungen an die Risikobewertung im Vorfeld des Audits wie für das vollständige Fernaudit. | Dieselben Anforderungen an die Risikobewertung im Vorfeld des Audits wie für das vollständige Fernaudit. |
| Die Zertifizierungsstelle muss die Unparteilichkeit des Begleiters sicherstellen und diese Nachweise als dokumentierte Information aufbewahren. | |||
| Auditzeitaufwand | Appendix 2 zu GMP+ CR2.0 70 % der Prüfungszeit müssen für den Kontakt mit der geprüften Stelle unter Verwendung von IKT-Werkzeugen aufgewendet werden. | Appendix 2 zu GMP+ CR2.0 70 % der Prüfungszeit müssen für den Kontakt mit der geprüften Stelle unter Verwendung von IKT-Werkzeugen aufgewendet werden. | Appendix 2 zu GMP+ CR2.0 70 % der Prüfungszeit müssen für den Kontakt mit der geprüften Stelle unter Verwendung von IKT-Werkzeugen aufgewendet werden. |
| Kompetenzen des Auditteams | Kompetenzen des Auditors gemäß GMP+ CR1.0 | Kompetenzen des Auditors gemäß GMP+ CR1.0 | Kompetenzen des Auditors gemäß GMP+ CR1.0 |
| Es obliegt der Verantwortung der Zertifizierungsstelle, zu ermitteln, ob der Begleiter kompetent ist. Während des Audits fällt der Begleiter unter die Verantwortung des für GMP+ zugelassenen Auditors und darf dieser während des Audits keine Schlussfolgerungen ziehen. | |||
| Allgemeine Anforderungen | Erfüllt die übrigen Anforderungen an das Zertifizierungsverfahren wie bei einem regulären Audit vor Ort. | Erfüllt die übrigen Anforderungen an das Zertifizierungsverfahren wie bei einem regulären Audit vor Ort. | Erfüllt die übrigen Anforderungen an das Zertifizierungsverfahren wie bei einem regulären Audit vor Ort. |
| 1 Wenn ein Unternehmen als Hauptstandort für einen oder mehrere Produktionsstandorte fungiert, ist das vollständige Fernaudit nicht gestattet. 2 Wenn ein Unternehmen als Hauptstandort für eine Matrixzertifizierungskonstruktion fungiert, ist das vollständige Fernaudit nicht gestattet. 3 Es gilt eine Ausnahme für Anwendungsbereiche, die Futtermittel physisch verarbeiten: Herstellung (alle Anwendungsbereiche), Lagerung und Umschlag von Futtermitteln, Straßentransport von Futtermitteln, Schienentransport von Futtermitteln. | |||



