1. Scope van dit document
Dit document bevat de acceptatievoorwaarden en procedures voor Certificatie Instellingen die van plan zijn de aanvragende organisatie/GMP+ gecertificeerde bedrijven te certificeren. Het definieert ook de compliance assessment met betrekking tot Certificatie Instellingen / Critical Locations die door GMP+ International wordt uitgevoerd. Daarnaast worden de audittijden uitgedrukt in dagen, 1 dag is gelijk aan 8 uur.
2. Normatieve verwijzingen
De volgende documenten, geheel of gedeeltelijk, worden in dit document normatief genoemd en moeten verplicht worden nageleefd. Voor gedateerde verwijzingen is alleen de geciteerde editie van toepassing. Voor ongedateerde verwijzingen is de laatste editie van het document waarnaar wordt verwezen (inclusief alle wijzigingen) van toepassing.
- ISO/IEC 17021-1:2015 Conformiteitsbeoordeling – eisen voor instellingen die audits en certificatie van management systemen leveren.
- ISO 22003-1:2022(E) Voorwaarden voor instellingen die audits en certificering van managementsystemen voor voedselveiligheid verzorgen.
- F0.1 Rechten en Plichten
- F0.2 Definitielijst
- F0.3 Scopes voor certificatie
- CR2.0 Beoordeling en certificering van Feed Safety Assurance scopes
- CR3.0 Beoordeling en certificering van Feed Responsibility Assurance scopes
3. Principes
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 4.1 |
4. Acceptatie
4.1. Algemeen
Een Certificatie Instelling die een aanvragende organisatie/GMP+ gecertificeerd bedrijf wil certificeren volgens 1 of meer GMP+ scope(s) moet aantoonbaar voldoen aan de in dit document gestelde voorwaarde in aanvulling op hoofdstuk 2. Indien de Certificatie Instelling voldoet aan de voorwaarden, zal GMP+ International de betreffende Certificatie Instelling accepteren.
4.2. Acceptatieprocedure
4.2.1. Aanvraag
De aanvragende Certificatie Instelling dient een aanvraag in met behulp van het aanvraagformulier dat is gepubliceerd op de website van GMP+ International. De aanvraag wordt in behandeling genomen wanneer:
- het aanvraagformulier volledig is ingevuld en alle gevraagde documenten zijn ontvangen;
- de aanvraagvergoeding voor de behandeling van de aanvraag is betaald (zie CR4.0 Tarieven);
- De aanvragende Certificatie Instelling moet twee geaccepteerde GMP+ auditors/inspecteurs hebben per door de Certificatie Instelling aangevraagde scope(s). De aanvragende Certificatie Instelling moet haar beslissing in overeenstemming met Appendix 1 motiveren en documenteren en moet alle gegevens ter beschikking houden voor beoordeling tijdens de acceptatie-audit.
GMP+ International zal deze aanvraag schriftelijk bevestigen. Indien de aanvragende Certificatie Instelling binnen de termijn van 26 weken na de eerste aanvraag door GMP+ International niet kan worden geaccepteerd, zal GMP+ International de acceptatieprocedure beëindigen. De aanvragende Certificatie Instelling mag dan niet binnen een jaar na de einddatum een nieuwe acceptatieprocedure starten.
4.2.2. Desk assessment
De desk assessment van de gevraagde documenten duurt minimaal 4 en maximaal 6 weken. De aanvragende Certificatie Instelling wordt door GMP+ International op de hoogte gebracht van de resultaten. Pas na een positief resultaat van de desk assessment wordt een acceptatie-audit uitgevoerd.
4.2.3. Acceptatie audit
Een acceptatie-audit is alleen mogelijk na een positief resultaat van de desk assessment. De duur van de acceptatie-audit on-site is minimaal 1 dag.
De auditbevindingen worden in de door GMP+ International opgestelde en gereviewde rapportage beschreven.
Pas als de auditbevindingen zijn opgelost kan de aanvragende Certificatie Instelling geaccepteerd worden.
4.2.4. Aanvragende Certificatie Instellingen die werken met Critical Locations
Indien tijdens de aanvraagprocedure wordt vastgesteld dat de Certificatie Instelling met Critical Location(s) werkt, geldt het volgende:
- De beoordeling van de Critical Location(s) maakt deel uit van de acceptatieprocedure van de aanvragende Certificatie Instelling.
- Voor de acceptatie-audit ter plaatse van de Critical Location zal GMP+ International de aanvragende Certificatie Instelling kosten in rekening brengen.
- De acceptatie van de aanvragende Certificatie Instelling kan alleen worden afgerond als de Critical Location(s) voldoet aan de voorwaarden zoals vermeld in het GMP+ Feed Certification scheme.
4.2.5. GMP+ Feed Certification scheme License Agreement
Als de aanvragende Certificatie Instelling voldoet aan de acceptatievoorwaarden dan:
- geeft GMP+ International een GMP+ Feed Certification scheme License Agreement (Appendix 6 van dit document) uit aan de aanvragende Certificatie Instelling die ondertekend moet worden.
- stuurt de Certificatie Instelling na ondertekening een van de originele exemplaren terug naar GMP+ International. De acceptatie is compleet na ontvangst van de ondertekende en gedateerde Feed Certification scheme License Agreement.
- zal GMP+ International de geaccepteerde Certificatie Instelling en indien van toepassing haar Critical Location(s) publiceren op het publieke deel van de GMP+ bedrijfsdatabase met een specificatie voor welke scopes de acceptatie van toepassing is (zie Appendix 5).
4.3. Acceptatievoorwaarden
4.3.1. Accreditatievoorwaarden
Een Certificatie Instelling en haar Critical Location(s) moeten beschikken over een geaccrediteerd kwaliteitsmanagementsysteem voor levensmiddelen/diervoeder op basis van ISO/IEC17021 en ISO22003-1. Behalve als de Certificatie Instelling en haar Critical Location(s) alleen binnen- en kustvaarttransport van diervoeder certificeren, moeten zij beschikken over een geaccrediteerd beheersysteem gebaseerd op ISO/IEC 17020 en/of op internationaal niveau werken volgens een goedgekeurd certificeringssysteem zoals ISO 9001 of gelijkwaardig, waarbij is aangetoond dat laadcompartimentinspectie (LCI) deel uitmaakt van de gecertificeerde scope.
4.3.2. Onpartijdigheidsbeheer
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 5.2 |
4.3.3. Vertrouwelijkheid
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 8.4 |
4.3.4. Aansprakelijkheid en Financiering
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 5.3 |
Daarnaast is artikel 12 van de GMP+ Feed Certification scheme License Agreement van toepassing.
4.3.5. Structurele voorwaarden
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 6 |
4.3.6. Resource voorwaarden
4.3.6.1. Competenties van het personeel
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 7.1 tot en met 7.4 |
| ISO 22003-1:2022(E) | Artikel 7.1.1 tot en met 7.1.3 |
Aanvullende voorwaarden voor de GMP+ coördinator/plaatsvervangend coördinator, GMP+ auditor, GMP+ inspecteur en GMP+ technical reviewer staan vermeld in Appendix 1; Certificatie Instellingen moeten ervoor zorgen dat aan deze voorwaarden wordt voldaan. De Certificatie Instelling moet haar beslissing volgens Appendix 1 motiveren en documenteren en moet alle gegevens ter beschikking houden voor beoordeling tijdens de Certificatie Instelling audit.
Een GMP+ auditor mag pas GMP+ audits uitvoeren als de GMP+ auditor voor de betreffende scope(s) in de GMP+ database is geaccepteerd.
De GMP+ technical reviewer mag pas een technische review uitvoeren als de GMP+ technical reviewer voor de betreffende scope(s) in de GMP+ database is geaccepteerd.
De Certificatie Instelling moet 1 persoon aanstellen als GMP+ coördinator en kan 1 persoon aanstellen als GMP+ plaatsvervangend coördinator voor de Certificatie Instelling. Een aanvraag voor acceptatie van een GMP+ coördinator en GMP+ plaatsvervangend coördinator moet worden ingediend bij GMP+ International door middel van het aanvraagformulier, zoals gepubliceerd op de website van GMP+ International.
4.3.6.2. Taken van de GMP+ coördinator/plaatsvervangend coördinator
De taken zijn:
- Contactpersoon bij GMP+ International,
- Acceptatie van GMP+ auditor, inspecteur en technische reviewer.
- Uitgeven van audittijd reductie.
- GMP+ International informeren over een Critical non-conformity(ies).
- Coördinatie van onderzoek,
- Ervoor zorgen dat de GMP+ Bedrijvendatabase up to date is (zie Bijlage 5).
- Interne harmonisatie, fysieke harmonisatie is verplicht met een minimum van eens per twee jaar. Deelname moet worden gedocumenteerd. Interne harmonisatie moet worden aangetoond door middel van een presentatie/notulen. Harmonisatie van auditors door de coördinator kan worden gedelegeerd aan externe partijen onder de volgende voorwaarden:
- Als de training wordt uitbesteed, dan moet de CI-coördinator samen met het derde partij de inhoud bepalen om voldoende diepgang te waarborgen.
- De inhoud van de training moet beschikbaar en verifieerbaar zijn tijdens CI-audits.
De Certificatie Instelling moet een procedure vaststellen voor het geval dat de GMP+ coördinator/plaatsvervangend coördinator taken delegeert aan een bevoegd persoon, exclusief taken 1 tot en met 4.
De functie van GMP+ coördinator/plaatsvervangend coördinator moet worden vervuld door een persoon verbonden aan de locatie en de geaccepteerde Certificatie Instelling.
Dit betekent:
- Betrokkenheid bij de Certificatie Instelling en het GMP+ Certificatieproces
- De GMP+-coördinator/plaatsvervangend coördinator moet een duidelijke en aantoonbare betrokkenheid hebben bij de ondersteuning van het GMP+-certificatieproces.
- Dit zorgt ervoor dat de GMP+-coördinator/plaatsvervangend coördinator actief betrokken is bij het GMP+-certificatieproces en werkt aan de verbetering hiervan.
- Kennis van de geaccepteerde scopes van de certificatie-instelling
- De GMP+-coördinator/ plaatsvervangend coördinator moet diepgaande kennis hebben van de GMP+-voorwaarden van de CI’s geaccepteerde scope(s) voor certificatie.
- Dit zorgt ervoor dat de GMP+-coördinator/plaatsvervangend coördinator de certificatievoorwaarden kan interpreteren en toepassen in contexten om de consistentie en integriteit van het certificatieproces te behouden en dit communiceert met de GMP+-auditoren en relevante medewerkers.
- Vertegenwoordiger van de Certificatie Instelling
- De GMP+-coördinator/ plaatsvervangend coördinator dient op te treden als een effectieve vertegenwoordiger van de CI, die bevoegd is om de naleving van de GMP+-voorwaarden te borgen.
- Dit zorgt ervoor dat de GMP+-coördinator/plaatsvervangend coördinator corrigerende en preventieve maatregelen implementeert om naleving van het GMP+-FC-schema te borgen.
- Aanzienlijke invloed op documentbeheer en interne processen
- GMP+-coördinator/plaatsvervangend coördinator moet een actieve rol spelen en de bevoegdheid hebben om de GMP+-documentatie en interne processen van de CI te reviewen en te actualiseren en zorgt ervoor dat interne documentatiesystemen aanwezig zijn om aan de GMP+-voorwaarden te voldoen.
- Dit zorgt ervoor dat de GMP+-documentatie voldoet aan de GMP+-voorwaarden en volledig geïntegreerd is in de operationele processen van de CI.
- Efficiënte en effectieve communicatie
- De GMP+-coördinator/plaatsvervangend coördinator moet toegankelijk zijn en nadrukkelijk aanwezig zijn bij GMP+-activiteiten. Dit omvat regelmatige interne vergaderingen of gesprekken op verzoek om opheldering te verschaffen over certificeringskwesties.
- Dit zorgt voor efficiënte en effectieve communicatie en borgt de continuïteit van het GMP+ certificatieproces.
4.3.7. Informatievoorwaarden
4.3.7.1. Openbare informatie
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 8.1 |
Bij het afsluiten van een GMP+ certificeringsovereenkomst met een aanvragende organisatie moet de Certificatie Instelling en/of Critical Location direct de bedrijfsgegevens, zoals vermeld in Appendix 5 van dit document, in de GMP+ Bedrijvendatabase invoeren:
In geval van een multi-site certificering of een certificering voor een tractionair moet het hoofdkantoor worden geregistreerd in de GMP+ Bedrijvendatabase en worden gekoppeld aan de multi-site locatie/tractionair.
Na een succesvolle initiële audit moeten de certificatiescopes worden toegevoegd.
De Certificatie Instelling en/of Critical Location moet de GMP+ Database binnen 2 weken aan te passen bij iedere wijziging van de hierboven en in Appendix 5 genoemde informatie.
Indien de naam, het adres en/of de vestigingsplaats/legal entity van de Certificatie Instelling of haar Critical- en Non Critical Location wijzigt, of in geval van sluiting/stoppen met GMP+ activiteiten, is de Certificatie Instelling verplicht GMP+ International hiervan 3 maanden van tevoren op de hoogte te stellen.
4.3.7.2. Uitwisseling van informatie tussen de Certificatie Instellingen en hun klanten
| De relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 8.5.1 en 8.5.2 |
De Certificatie Instelling moet alle relevante certificeringsdocumentatie/informatie gedurende ten minste zes jaar bewaren.
4.3.8. GMP+ International harmonisatie
GMP+ International organiseert 2 Feed Safety Assurance (FSA) en 1 Feed Responsibility Assurance (FRA) harmonisatievergaderingen per jaar. Op basis van de acceptatie van de Certificatie Instelling moet bij elke bijeenkomst de GMP+ coördinator of GMP+ plaatsvervangend coördinator van de geaccepteerde Certificatie Instelling aanwezig zijn. Indien er onvoldoende relevante agendapunten zijn voor een Certificatie Instelling, kan GMP+ International besluiten tot een individuele ontheffing van de aanwezigheidsverplichting.
Elke Certificatie Instelling is verplicht GMP+ International jaarlijks minimaal 1 casus voor FSA en 1 casus voor FRA tijdig te overleggen om deze te bespreken tijdens de harmonisatievergadering.
4.3.9. Procedures en Documenten voor GMP+ certificering
De Certificatie Instelling moet beschikken over een actuele gedocumenteerde procedure(s) en documenten/templates waarin het GMP+ certificeringsproces wordt beschreven (aanvraag tot en met afgifte van het certificaat) en de afhandeling van EWS-meldingen. Deze gedocumenteerde procedure(s) en documenten/templates moet(en) deel uitmaken van het kwaliteitsmanagementsysteem van de Certificatie Instelling.
Voor het beheer van gedocumenteerde procedure(s) en documenten/templates moet de Certificatie Instelling, voor zover van toepassing, het volgende regelen:
- verspreiding, toegang, opvraging en gebruik;
- opslag en behoud, met inbegrip van het behoud van de leesbaarheid;
- beheer van wijzigingen (bijv. versiebeheer);
- bewaring en verwijdering.
Bij wijzigingen in de certificatievoorwaarden moet de Certificatie Instelling deze uiterlijk op de implementatiedatum implementeren.
5. Compliance assessment
5.1. Algemeen
GMP+ International houdt toezicht op de naleving door de Certificatie Instellingen van hetgeen is vastgelegd in de relevante CR-documenten, F-documenten en de ondertekende licentieovereenkomst.
De criteria zoals vastgelegd in dit document worden gebruikt voor compliance assessment audits en voor het vaststellen van sancties.
5.2. Compliance assessment van Certificatie Instellingen, Critical Location(s) en GMP+ auditoren/inspecteurs
De compliance assessment van de Certificatie Instellingen en Critical Location(s) die GMP+ International uitvoert, bestaat uit:
5.2.1. Compliance Desk Assessment
Compliance Desk Assessment is om vast te stellen of de Certificatie Instelling en de Critical- en Non Critical Location(s) voldoen aan de voorwaarden die zijn vastgelegd in de GMP+ Feed Certification scheme.
5.2.2. Compliance Audits
De volgende Compliance Audits zijn van toepassing.
5.2.2.1. Witness Audits (WA-rapportage)
GMP+ International houdt toezicht op de GMP+ auditors/inspecteurs, door hun werkwijze en de wijze waarop zij hun bevindingen tijdens de uitvoering van hun auditclassificatie, te beoordelen. Indien de GMP+ International auditor vaststelt dat een risico voor de voederveiligheid/verantwoord diervoeder niet wordt geïdentificeerd tijdens de audit, wordt de GMP+ auditor voor de afsluitende vergadering door de GMP+ International auditor geïnformeerd om te bevestigen of er sprake is van een risico voor de voederveiligheid/verantwoord diervoeder. Tijdens een herhalingsaudit/inspectie kan GMP+ International besluiten om een witness audit uit te voeren van de betrokken auditor/inspecteur.
5.2.2.2. Parallel Audits (PA-rapportage)
GMP+ International voert parallelaudits uit bij GMP+ gecertificeerde bedrijven om de methode waarmee een audit wordt gepland, uitgevoerd en gerapporteerd door de Certificatie Instelling te verifiëren. De parallelaudit vindt plaats nadat de audit door de Certificatie Instelling is uitgevoerd.
5.2.2.3. CB Office Audits (CB-rapportage)
GMP+ International voert ten minste eenmaal per jaar een audit uit bij de Certificatie Instellingen om de implementatie van de voorwaarden van het GMP+ Feed Certification scheme te beoordelen. Deze audit is een volledige beoordeling van alle voorwaarden. De minimale auditduur is 1 dag. Het referentiedocument voor de beschrijving van NCRs is van toepassing (Appendix 4.2).
5.2.2.4. Critical Location(s) Audit (CL-rapportage)
GMP+ International voert minimaal één keer per 2 jaar een audit uit van de Critical Location(s) om de implementatie van de voorwaarden van het GMP+ Feed Certification scheme te beoordelen. De minimale auditduur is 1 dag.
5.2.2.5. Non-Critical Location(s) Audit (NCL reportage)
Op basis van objectief bewijs uit een CB Office Audit kan GMP+ International een Non-Critical Location audit uitvoeren om de implementatie van de voorwaarden uit het GMP+ Feed Certification scheme te beoordelen. De minimale audittijd is één dag
5.2.3. Analyse
5.2.3.1. Retrospectieve analyse
Retrospectieve analyse van de GMP+ gecertificeerde onderneming/GMP+ auditor, die gebaseerd is op bijzondere gebeurtenissen en niet op een regelmatige basis:
- Retrospectieve analyse van het certificatieproces (RAC-rapportage)
Het is een analyse van de rapportages van alle certificatie-audits en, indien beschikbaar, ook van de compliance audits die in de afgelopen 36 maanden bij een bepaald bedrijf zijn uitgevoerd.
- Retrospectieve analyse van een GMP+ auditor (RAA-rapportage)
Het is een analyse van de rapportages van alle certificatie-audits die door een bepaalde GMP+ auditor worden uitgevoerd voor een aantal door GMP+ International vast te stellen rapportages die betrekking hebben op de relevante scope(s).).
5.2.3.2. Overall analysis
Overall analysis van het presteren van de certificering (OA-rapportage).
Het is een jaarlijkse analyse van het presteren van een Certificatie Instelling gedurende de laatste drie kalenderjaren, gebaseerd op ten minste:
- Geïdentificeerde non-conformities per GMP+ auditor
- Bevindingen/NCRs van GMP+ compliance audits;
- Deelname en inbreng in harmonisatievergaderingen;
- Examenresultaten van de GMP+ auditors;
- Compliance assessment van de Critical Location(s), indien van toepassing.
Het eindresultaat van de overall analysis kan leiden tot een aanvullende compliance assessment voor de Certificatie Instelling en/of Critical Location(s). De kosten voor de aanvullende compliance assessment kunnen aan de Certificatie Instelling in rekening worden gebracht. Indien een actie/verbeteringsplan wordt gevraagd door GMP+ International is de Certificatie Instelling verplicht een dergelijk actie/verbeteringsplan in te sturen binnen het tijdsbestek gevraagd door GMP+ International.
5.2.4. Examinering
Examinering van GMP+ auditors, technical reviewers en inspecteurs is een instrument om de kennis en kennistoepassing van de GMP+ auditors, GMP+ technical reviewers en GMP+ inspecteurs te meten volgens de voorwaarden van het GMP+ Feed Certification scheme, inclusief de classificering van non-conformities.
5.2.5. Rapportagebeoordeling
Op basis van willekeurige steekproeven zal GMP+ International de GMP+ auditrapportage / de checklist beoordelen van de audits die door de Certificatie Instellingen in het kader van het GMP+ Feed Certification scheme worden uitgevoerd. De Certificatie Instelling moet de informatie direct op verzoek verstrekken.
5.3. Vaststelling en Registratie van de bevindingen
In aanvulling op Appendix 4 voor de artikelen 5.2.1, 5.2.2, 5.2.3.1 en 5.2.5 geldt het volgende:
Nadat de compliance assessment is uitgevoerd door GMP+ International worden de NCR(s) opgesteld door de GMP+ International auditor en overhandigd aan de GMP+ coördinator en/of GMP+ plaatsvervangend coördinator van de Certificatie Instelling. GMP+ International is verantwoordelijk of de geobserveerde NCR(s) gerechtvaardigd en goed geclassificeerd zijn. Non-conformities die tijdens de Critical Location-audit worden vastgesteld, worden altijd aan de aansprakelijke Certificatie Instelling verstrekt.
NCR(s) kunnen alleen worden gesloten indien de betrokken Certificatie Instelling een oorzakenanalyse uitvoert en corrigerende en/of preventieve acties onderneemt en indien van toepassing, moet de betrokken Certificatie Instelling objectief bewijs aan GMP+ International overleggen.
GMP+ International noemt deze acties Corrective Action Report (hierna: CAR).
Minor en/of Major non-conformities:
De GMP+ International auditor en GMP+ International (technical) reviewer zijn verantwoordelijk voor het afronden van het compliance report en voor het beoordelen van de CAR(s) en het afsluiten van de NCR(s).
Critical non-conformities:
GMP+ International is verantwoordelijk voor het nemen van de beslissing om de NCR(s) te sluiten en/of te upgraden / downgraden en om het compliance assessment report definitief te maken.
5.4. Rapportage
Voor alle beoordelingen zoals genoemd in artikel 5.2 (met uitzondering van artikel 5.2.4) wordt een rapportage in de Engelse taal aan de Certificatie Instelling verstrekt. Daarnaast kan het compliance report voor alle auditsoorten zoals genoemd in artikel 5.2 (met uitzondering van artikel 5.2.4) ook in de Duitse of Nederlandse taal aan de Certificatie Instelling worden verstrekt.
5.5. Maatregelen en Sancties
Indien GMP+ International vaststelt dat een Certificatie Instelling niet voldoet aan de voorwaarden en verplichtingen van het GMP+ Feed Certification scheme of de GMP+ Feed Certification scheme Licence Agreement, zal zij één van de maatregelen of sancties onder a) tot en met e) opleggen aan de Certificatie Instelling. De Certificatie Instelling wordt indien nodig geïnformeerd door middel van een officiële brief.
- Waarin een termijn wordt vermeld waarbinnen de Certificatie Instelling /Critical Location moet voldoen aan de voorwaarden van het GMP+ Feed Certification scheme. De Certificatie Instelling wordt gevraagd om binnen een vastgestelde termijn een Corrective Action Report te overleggen;
- Dat de GMP+ Feed Certification scheme Licence Agreement met een Certificatie Instelling niet wordt verlengd;
- Dat de GMP+ Feed Certification scheme Licence Agreement voor een periode van maximaal 3 maanden wordt geschorst, waardoor het voor de Critical Location en Non- Critical Location automatisch niet is toegestaan om gedurende dezelfde periode GMP+ activiteiten uit te voeren;
- Dat de GMP+ Feed Certification scheme Licence Agreement mogelijk na schorsing wordt beëindigd, waardoor de Critical Location en Non-Critical Location automatisch geen GMP+ activiteiten meer mogen uitvoeren;
- Dat het niet verlengen, schorsen en beëindigen zoals genoemd onder b, c en d openbaar wordt gemaakt.
Tijdens een schorsing als genoemd onder c moet de Certificatie Instelling ervoor zorgen dat al haar verplichtingen in het kader van het GMP+ Feed Certification scheme worden overgenomen door een andere door GMP+ geaccepteerde Certificatie Instelling.
Als gevolg van het niet verlengen/beëindigen als bedoeld onder b en d wordt de betreffende Certificatie Instelling voor een periode van minimaal 1 jaar uitgesloten van deelname aan het GMP+ Feed Certification scheme. GMP+ International informeert de betrokken GMP+ gecertificeerde bedrijven.
Appendix 1: Competenties van personeel
Appendix 1.1 GMP+ auditor FSA
| Positie: GMP+ auditor FSA | ||
| | Kandidaat auditor | Geaccepteerd auditor |
| Opleiding |
| Zie kandidaat auditor |
| Kennis van |
Bovendien:
| Zie kandidaat auditor |
| Auditvaardigheden |
| Zie kandidaat auditor |
| Auditervaring |
en,
|
|
| Werkervaring |
Uitzondering:
| Zie kandidaat auditor |
| Interne harmonisatie | Elke kandidaat GMP+ auditor moet aantoonbaar een initiële training hebben gevolgd, gericht op de betreffende scope(s). |
|
| Examinering | Slagen voor de van toepassing zijnde examens. De GMP+ examenregeling en Appendix 2.1 zijn van toepassing. | Zie kandidaat auditor |
| *ook van toepassing op de technisch expert | ||
Appendix 1.2 GMP+ auditor FRA
| Positie: GMP+ auditor FRA | ||
| | Kandidaat auditor | Geaccepteerd auditor |
| Opleiding | - Relevante landbouw, voedselveiligheid/technologie, logistiek of transport ten minste op Bachelor niveau of een gelijkwaardig ervaringsniveau. | Zie kandidaat auditor |
| Kennis van |
Voor de audit van MI5.1, MI5.2, MI5.3 en MI5.6 moet de GMP+ auditor:
Voor het auditen van MI5.4 GMO Controlled moet de GMP+ auditor:
| Zie kandidaat auditor |
| Auditvaardigheden |
| Zie kandidaat auditor |
| Auditervaring |
en
|
|
| Werkervaring |
| Zie kandidaat auditor |
| Interne harmonisatie | Elke kandidaat GMP+ auditor moet aantoonbaar een initiële training hebben gevolgd, gericht op de betreffende scope(s). Zie “Kennis van”. |
|
| Examinering | Niet van toepassing | Niet van toepassing |
| 1 Voorwaarden voor de trainer: De trainer moet in het bezit zijn van een certificaat van de MI5.1, MI5.2, MI5.3 en MI5.6-training die in het verleden door GMP+ International is verzorgd en/of de trainer is geslaagd voor de RTRS endorsed training en moet een GMP+ geaccepteerde auditor zijn voor een van de van toepassing zijnde FRA-scopes. 2 Voorwaarden voor de trainer: De trainer moet altijd in het bezit zijn van een geldig VLOG "Ohne Gentechnik"-certificaat en moet een GMP+ geaccepteerde auditor zijn voor MI5.4. | ||
Appendix 1.3 GMP+ technical reviewer FSA/FRA
| Positie: GMP+ technical reviewer FSA/FRA | ||
| | Kandidaat technical reviewer | Geaccepteerd technical reviewer |
| Opleiding |
| Zie kandidaat technical reviewer |
| Kennis van |
In aanvulling op FSA:
In aanvulling op FRA: Kennis en vaardigheid met betrekking tot methoden en technieken gericht op:
| Zie kandidaat technical reviewer |
| Auditvaardigheden | Lead assessor of FSSC Lead assessor training (minimaal 40 uur, IRCA erkend, of aantoonbaar equivalent). Niet van toepassing op de review van TS3.3 Binnen- en kustvaarttransport van diervoeder | Zie kandidaat technical reviewer |
| Review-/auditervaring |
| Uitvoeren/bijwonen van minimaal 5 audits per scope per jaar, waarvoor de GMP+ technical reviewer is geaccepteerd, of beoordelen van 5 rapportages / inspectiechecklists voor de betreffende scope. |
| Werkervaring |
Uitzondering:
| Zie kandidaat technical reviewer |
| Interne harmonisatie | Elke kandidaat GMP+ technical reviewer moet aantoonbaar een initiële training hebben gevolgd, gericht op de betreffende scope(s). |
|
| Examinering | Slagen voor de van toepassing zijnde examens. De GMP+ examenregeling en Appendix 2.1 zijn van toepassing. | Zie kandidaat technical reviewer |
Appendix 1.4 GMP+ inspecteur
| Positie: GMP+ Inspecteur | ||
| | Kandidaat inspecteur | Geaccepteerd inspecteur |
| Opleiding | Succesvol afgerond middelbaar beroepsonderwijs of ten minste een gelijkwaardig ervaringsniveau. | Zie kandidaat inspecteur |
| Kennis van |
| Zie kandidaat inspecteur |
| Inspectie-ervaring |
| Minstens 5 on-site inspectie per jaar
|
| Werkervaring | Werkervaring in de diervoeder / levensmiddelensector in een relevante functie (bijvoorbeeld de uitvoering van een LCI). | Zie kandidaat inspecteur |
| Interne harmonisatie | Elke kandidaat-inspecteur moet aantoonbaar een initiële training hebben gevolgd. | Elke inspecteur woont per kalenderjaar minstens 8 uur interne harmonisatie bijeenkomst bij die door de Certificatie Instelling wordt georganiseerd.
|
| Examinering | Slagen voor de van toepassing zijnde examens. De GMP+ examenregeling is van toepassing. | Zie kandidaat inspecteur |
Appendix 1.5 GMP+ coördinator
| Positie: GMP+ coördinator (die geen GMP+ audits uitvoert) | ||
| | Kandidaat GMP+ (deputy) coordinator | Geaccepteerd GMP+ (deputy) coordinator |
| Opleiding | Bachelor diploma of gelijkwaardig ervaringsniveau als minimum. | Zie kandidaat GMP+ (deputy) coordinator |
| Kennis van |
| Zie kandidaat GMP+ (deputy) coordinator |
| Auditvaardigheden | Lead assessor of FSSC Lead assessor-training (minimaal 40 uur, IRCA erkend, of aantoonbaar equivalent). | Zie kandidaat GMP+ (deputy) coordinator |
| Auditervaring | Er moeten 7 GMP+ on-site audits of inspecties worden uitgevoerd en/of als observator, gelijkwaardige certificatieschema's zoals vermeld in TS1.2 Inkoop zijn van toepassing. | Per 24 maanden moeten 7 GMP+ audits/ inspecties en/of gelijkwaardige certificeringschema's zoals vastgelegd in TS1.2 Inkoop worden uitgevoerd en/of als observator. |
| Werkervaring | Werkervaring in de diervoeder/levensmiddelensector in een relevante functie (bijvoorbeeld kwaliteitsborging, productie, advies over Feed Safety Management Systems, laboratorium). | Zie kandidaat GMP+ (deputy) coordinator |
| Interne harmonisatie | Elke coördinator/plaatsvervangend coördinator moet aantoonbaar een initiële training hebben gevolgd. | De coördinator/plaatsvervangend coördinator moet minimaal 8 uur harmonisatie bijwonen tot een maximum van 24 uur per kalenderjaar, afhankelijk van het aantal scopes waarvoor de betreffende Certificatie Instelling wordt geaccepteerd. Dit kan niet worden gedelegeerd.
|
| Examinering | Niet van toepassing | Niet van toepassing |
Appendix 2: Tabel met vrijstellingen
In deze tabel zijn de vrijstellingen met betrekking tot examinering, acceptatie en interne harmonisatie aangegeven. Elke GMP+ scope die bovenaan de tabel staat, geeft de vrijstelling aan voor met de relevante scope in de linker kolom die met een X is aangegeven. De tabel is niet omgekeerd van toepassing.
Appendix 2.1 Tabel met vrijstellingen, acceptatie en interne harmonisatie en examinering
| | Productie van meng-voeder | Productie van voormengsels | Productie van toevoegingsmiddelen | Productie van voeder-middelen | Handel in diervoeder | Op- en Overslag van diervoeder | Weg-transport van diervoeder | Bevrachting | Weg-transport van diervoeder & Bevrachting | Laboratorium-onderzoek |
| Productie van mengvoeder1 | | X | | | | | | | | |
| Productie van mengvoeder - huisdiervoeder Productie van mengvoeder - GMO controlled | X | X | | | | | | | | |
| Productie van voormengsels1 | X | | | | | | | | | |
| Productie van voormengsels - GMO controlled | X | X | | | | | | | | |
| Productie van toevoegingsmiddelen1 | | | | X | | | | | | |
| Productie van toevoegingsmiddelen - GMO controlled | | | X | X | | | | | | |
| Productie van voedermiddelen1 | | | X | | | | | | | |
| Productie van voedermiddelen - huisdiervoeder Productie van voedermiddelen - GMO controlled | | | X | X | | | | | | |
| Handel in diervoeder | X | X | X | X | | | | | | |
| Handel in diervoeder - huisdiervoeders Handel aan veehouderijen Handel in diervoeder - GMO controlled | X | X | X | X | X | | | | | |
| Op- en Overslag van diervoeder | X | X | X | X | | | | | | |
| Op- en Overslag van diervoeder - GMO controlled | X | X | X | X | | X | | | | |
| Wegtransport van diervoeder - GMO controlled | | | | | | | X | | | |
| Bevrachting van kustvaarttransport Bevrachting van binnenvaarttransport Bevrachting van zeetransport Bevrachting van railtransport | | | | | | | | X | | |
| Bevrachting van wegtransport | | | | | | | X | | | |
| Antibioticavrije productielijn(en) | X | X | X | X | | | | | | |
| Antibioticavrije productielocatie | X | X | X | X | | | | | | |
| Carbon footprint of feed | X | X | X | X | | | | | | |
| Dioxine-monitoring in diervoeder voor leghennen | X | | | | | | | | | |
| QM-Milch | X | X | X | X | X | | | | | |
| RTRS | X | X | X | X | X | | | | | |
| Verantwoord melkveevoeder | X | | | | X | | | | | |
| Verantwoord diervoeder | X | X | X | X | X | | | | | |
| Verantwoord varkens- & pluimveevoeder | X | X | X | X | X | | | | | |
| Geregistreerd laboratorium | | | | | | | | | | X |
| Railtransport van diervoeder | | | | | | | | | X | |
| 1 Niet van toepassing op examens | ||||||||||
Appendix 2.2 Tabel met vrijstellingen met betrekking tot de auditfrequentie
Met betrekking tot het behoud van de acceptatie voor een auditor/technical reviewer/inspecteur voor zover het gaat om de voorwaarde van minimaal 5 audits per jaar per scope, zijn de audits/review/inspectie die plaatsvinden bij relevante bedrijven onder de geaccepteerde certificaten zoals vermeld in TS 1.2 Inkoop van toepassing. Aanvullend kan ook onderstaande tabel van toepassing zijn.
| Een audit voor: | Geldt ook als een audit voor: |
| GMP+ scope:
| GMP+ scope :
|
| GMP+ scope:
| GMP+ scope :
|
| GMP+ scope:
| GMP+ scope :
|
| GMP+ scope:
| GMP+ scope :
|
| GMP+ scope:
| GMP+ scope :
|
| GMP+ scope:
| GMP+ scope
|
| GMP+ scope:
| GMP+ scope
|
| GMP+ scope:
| GMP+ scope
|
| VLOG – ‘Ohne Gentechnik’ Production and Certification Standard | GMP+ scope
|
| OQUALIM-STNO Technical Platform “GMO free fed” | GMP+ scope
|
| Let op: de scopes in de linker kolom van deze tabel zijn van toepassing op de scopes in de rechterkolom, maar niet andersom. | |
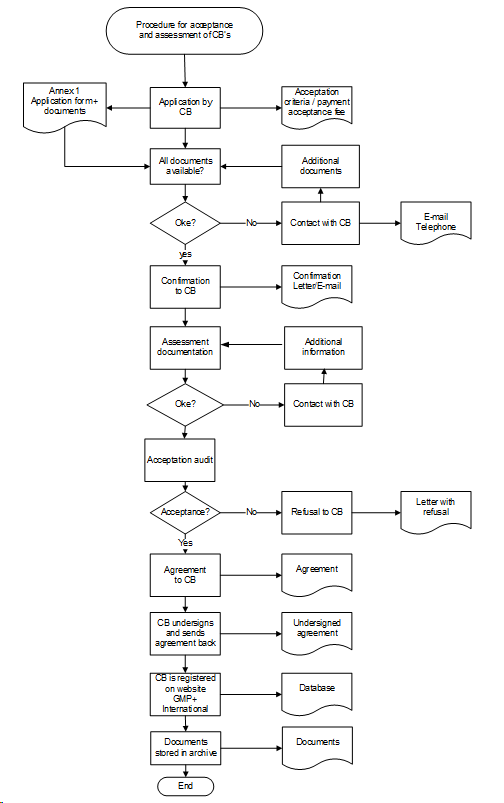
Appendix 3: Procedure voor de Acceptatie en Beoordeling van Certificatie Instellingen
Appendix 4: Beoordelingscriteria
Appendix 4.1 Beoordelingscriteria en Sancties
Non-conformities moeten worden geclassificeerd op basis van:
- De algemene beoordelingscriteria zoals vermeld in deze Appendix
- De genoemde sancties moeten minimaal worden opgelegd. GMP+ International mag strengere sancties opleggen.
CAR(s) moet(en) uiterlijk twee weken voor de deadline naar GMP+ International worden gestuurd. GMP+ International is verantwoordelijk voor het nemen van de beslissing om de non-conformities te sluiten.
| Classificatie: Minor non-conformity | |||
| Omschrijving | Gevolgen | Periode om te sluiten | |
| Certificatie Instellingen
| < 5 non-conformities | Voldoen aan de acceptatievoorwaarden | Binnen max. 6 maanden (beslist door GMP+ Int.) |
| ≥5 non-conformities | Voldoen niet aan de acceptatievoorwaarden | Binnen 10 weken | |
| Classificatie: Major non-conformity | ||
| Omschrijving | Gevolgen | Periode om te sluiten |
| Certificatie-instellingen
| Voldoen niet aan de acceptatievoorwaarden | binnen 6 weken |
| Classificatie: Critical non-conformity | ||
| Omschrijving | Gevolgen | Periode om te sluiten |
| Certificatie-instellingen
| niveau.1 De GMP+ acceptatie kan alleen worden voortgezet als de NCR wordt gesloten. | Binnen 1 week |
| niveau.2 GMP+ acceptatie wordt geschorst: maximaal 3 maanden | ||
| niveau.3 De GMP+ acceptatie wordt beëindigd | ||
| Certificatie-instellingen
| niveau.1 GMP+ acceptatie wordt geschorst: maximaal 3 maanden | |
| niveau. 2 De GMP+ acceptatie wordt beëindigd | ||
Appendix 4.2 - Referentiedocument voor de omschrijving van NCR’s voor GMP+ geaccepteerde Certificatie Instellingen
| Art. Nr. CR documenten | Ref. nr. | NCR’s CB audits / Compliance Desk Assessment / rapportage assessment / Retrospectieve analyse |
| | | ALGEMEEN |
| 1.0 | Non-compliance bij de beoordeling van EWS-dossiers | |
| CR1.0 art. 1.0 / Appendix 8.1 art.2.9 | 1.1 | Non-compliance bij de beoordeling van het contract/SLA met critical/non-critical locations. |
| 1.2 | Non-compliance met betrekking tot interne procedures van de CI. | |
| 1.3 | Documenten / QM-systeemdocumentation is niet up-to-date. | |
| 1.4 | Non-compliance met de accreditatievoorwaarde(n). | |
| | | CERTIFICATIEOVEREENKOMST |
| 2.0 | Geen overeenkomst tussen de CI en GMP+ gecertificeerd bedrijf.. | |
| 2.1 | De overeenkomst is niet afgesloten met de juiste rechtspersoon. | |
| 2.2 | Non-compliance van de minimaal verplichte audittijden. | |
| 2.3 | Non-compliance vanwege herberekening. | |
| 2.4 | De voorwaarden uit het GMP+ FC schema zijn niet geborgd in de overeenkomst. | |
| 2.5 | Non-compliance offerte aan de bedrijven. | |
| 2.6 | Non-compliance onpartijdigheid. | |
| CR1.0 art. 4.2 / Appendix 8.1 and 8.4 | 2.7 | Non-compliance met betrekking tot kernactiviteiten |
| CR2.0 art. 5.1.3 / Appendix 2 | 2.8 | Non-compliance van de criteria voor de berekening van de minimaal verplichte audittijden. |
| CR2.0 art.5.1.2 | 2.9 | Non-compliance bij de toepassing review/pre-transfer review |
| | | PLANNING, GMP+ BEDRIJVENDATABASE, ROTATIE AUDITORS |
| F0.1 art. 4.4 | 3.0 | De GMP+ Company Database is niet up to date. |
| CR1.0 art. 4.3.6.1 | 3.1 | Non-compliance auditor documentatie-acceptatie |
| CR2.0 art. 5.1.5.1 | 3.2 | Non-compliance met de rotatievoorwaarden |
| CR1.0 art. 4.3.6.1 | 3.3 | Non-compliance met de auditfrequentie. |
| CR1.0 art. 4.3.6.1 | 3.4 | Non-compliance met de minimaal verplichte interne harmonisatie-uren. |
| CR2.0 art. 5.2.1 | 3.5 | Non-compliance met de auditplanning. |
| CR2.0 art. 5.1.3 / Appendix 2 | 3.6 | Non-compliance met verminderingen van de audittijd. |
| CR1.0 art. 4.3.6.1 | 3.7 | Non-compliance auditoracceptatie. |
| CR2.0 art. 5.1.4 and 5.1.6 | 3.8 | Non-compliance auditplan |
| | | CERTIFICERING, REVIEW |
| CR2.0 art. 5.2.4 / Appendix 1 | 4.0 | Incorrecte classificatie van non-conformity. |
| CR2.0 art. 5.1 and 5.2 | 4.1 | Incorrect certificatieproces. |
| CR2.0 art. 5.1.2 and 5.2.7 | 4.2 | Non-compliance in het reviewproces. |
| CR2.0 art. 5.2.1 | 4.3 | Non-compliance auditfrequentie in de certificatiecyclus. |
| CR2.0 art. 5.2.8 and 5.2.9.3 | 4.4 | Non-compliance certificatiebeslissing. |
| | | GMP+ CERTIFICATEN/TIJDELIJKE ACCEPTATIE |
| CR2.0 art. 5.2.9 / CR3.0 art. 4.2.8 | 5.0 | Non-compliance in uitgegeven certificaten/tijdelijke acceptatie. |
| | | ASSESSMENT EN RAPPORTAGE |
| CR2.0 art. 5.2.6 / CR3.0 art. 4.2.5 | 6.1 | Non-compliance in rapportages. |
| CR2.0 art. 5.2.6 / CR3.0 art. 4.2.5 | 6.2 | Non-compliance bij het afhandelen van de rapportage met het GMP+ gecertificeerde bedrijf. |
| | | PARALLEL EN WITNESS AUDITS |
| CR2.0 art. 5.1, 5.2 and 5.4 / CR3.0 art. 4.1, 4.2 and 4.4 | 8.1 | Non-compliance bij de planning van de audit |
| CR2.0 art. 5.2 / CR3.0 art. 4.2 | 8.2 | Non-compliance bij de uitvoering van de audit |
| CR2.0 art. 5.2 / CR3.0 art. 4.2 | 8.3 | Non-compliance bij de rapportage van de audit |
Appendix 4.3 - Referentiedocument voor de omschrijving van de bevindingen bij GMP+ gecertificeerde bedrijven die worden vastgesteld tijdens parallel audits.
| Ref. nr. | Bevindingen tijdens parallel audits |
| 11.0 | Niet-naleving binnen de context van het GMP+ gecertificeerde bedrijf R1.0; 4.1, 4.2, 4.3, 4.4 |
| 11.1 | Niet-naleving binnen Leiderschap R1.0; 5.1, 5.2, 5.3 |
| 11.2 | Niet-naleving binnen Planning R1.0; 6.1, 6.2 |
| 11.3 | Niet-naleving binnen Ondersteuning R1. 0; 7.1, 7.2, 7.3, 7.4, 7.5 / TS1.1; 1.0, 2.0 / TS 1.2; 3.0, 4.0 / TS1.3; 1.0 / TS1.4; 1.0, 2.0 / TS1.8; 1. 0, 2.0 |
| 11.4 | Niet-naleving binnen Operatie R1.0; 8.1, 8.2, 8.3, 8.4, 8.5, 8.6, 8.7 / TS1.1; 3.0, 4.0, 5.0, 6. 0, 7.0, 8.0, 9.0, 10.0 / TS 1.5; 2.0 / TS 1.7; 1.0, 2.0, 3.0, 4.0, 5.0, 6.0 / TS 1.6; 2.0 / TS1.10; 1.1, 1.2, 1.3, 1. 4, 1.5, 1.6, 1.7, 1.8, 1.9, 1.10 / TS 1.11; 2.0, 3.0 |
| 11.5 | Niet-naleving binnen Beoordeling van de prestaties van het FSMS R1. 0; 9.1, 9.2, 9.3 |
| 11.6 | Niet-naleving binnen Verbetering R1.0; 10.1, 10.2, 10.3 |
| 11.7 | Niet-naleving binnen Het bestellen van transport van diervoeder TS1.9; 2.0 |
| 11.8 | Niet-naleving binnen Bevrachting van laadcompartimenten TS1.9; 3.1, 3.2 |
| 11.9 | Niet-naleving binnen Transport van diervoeder TS1.9; 4.1, 4.2, 4.3 |
| 11.10 | Niet-naleving binnen Country Note Dioxinemonitoring voor pluimveevoeder TS2.1; 2.0, 4.0 |
| 11.11 | Niet-naleving binnen Country Note Antibioticavrij diervoeder TS2. 2; 2.0, 4.0 |
| 11.12 | Niet-naleving binnen Country Note QM-Milch TS2.3; 2.0, 4.0, 5.0 |
| 11.13 | Niet-naleving binnen Inleiding TS3.1; 1.1, 1.3 |
| 11.14 | Niet-naleving binnen HACCP-systeemvoorwaarden TS3.1; 3.1, 3.2, 3.3 |
| 11.15 | Niet-naleving binnen Basisvoorwaarden TS3.1; 4.1, 4.2, 4.3, 4.4, 4.5 |
| 11.16 | Niet-naleving binnen Procesbeheersing TS3.1; 5.1, 5.2, 5.3, 5.4, 5.5 |
| 11.17 | Niet-naleving binnen Inleiding TS3.2; 0.1 |
| 11.18 | Niet-naleving binnen Beheersysteem voor de veiligheid van huisdiervoeder TS3.2; 1.1, 1.2 |
| 11.19 | Niet-naleving binnen Basisvoorwaardenprogramma's TS3.2; 2.1, 2.2, 2.3, 2.4, 2.5, 2.6, 2.7, 2.8, 2.9, 2.10, 2.11 |
| 11.20 | Niet-naleving binnen HACCP-systeem TS3.2; 3.1, 3.2, 3.3 |
| 11.21 | Niet-naleving binnen Systeemvoorwaarden R5.0; 4.1, 4.2, 4.3, 4.4, 4.5, 4.6 |
| 11.22 | Niet-naleving binnen supply chain modellen R5.0; 5.1, 5.2, 5.3, 5.4, 5.5 |
| 11.23 | Niet-naleving binnen Productie en Handel van RTRS-soja MI5.1; 4.1, 4.2, 4.3, 4.4 |
| 11.24 | Niet-naleving binnen Verantwoord varkens en pluimveevoeder MI5.2; 4.1, 4.2 |
| 11.25 | Niet-naleving binnen Verantwoord melkveevoeder MI5.3; 4.1, 4.2 |
| 11.26 | Niet-naleving binnen GMO controlled MI5.4; 4.1, 4.2, 4.3, 4.4, 4.5, 4.6 |
| 11.27 | Niet-naleving binnen Supply chain modellen MI5.4; 5.1 |
| 11.28 | Niet-naleving binnen Monstername en testen MI5.4; 6.1, 6.2, 6.3 |
| 11.29 | Niet-naleving binnen Systeemvoorwaarden MI5.5; 4.0 |
| 11.30 | Niet-naleving binnen Input voor de CFP-berekeningen MI5.5; 5.1, 5.2, 5.3, 5.4 |
| 11.31 | Niet-naleving binnen Berekening van het CFP van diervoeder MI5.5; 6.1, 6.2, 6.3, 6.4, 6.5 |
| 11.32 | Niet-naleving binnen Aanvullende berekening van emissiefactoren voor methaanproductie van diervoeder MI5.5; 7.0 |
| 11.33 | Niet-naleving binnen Compensatie van de CPF-LUC-indicator MI5.5; 8.0 |
| 11.34 | Niet-naleving binnen Informeren van de klant MI5.5; 9.0 |
| 11.35 | Niet-naleving binnen Productie en handel van verantwoord diervoeder MI5.6; 4.1, 4.2 |
| 11.36 | Niet-naleving binnen Gebruik van GMP+ FC Logo's / Handelsmerken F01; 6.0 |
| 11.37 | Niet-naleving binnen Kust- en Binnenvaarttransport van diervoeder TS3.3; 1a-b, 1.5, 2, 3, 4.2, 5a-b-c, 6, 7, 8, 9a-b-c, 10, 11, 12, 13, 14, 15, 16, Bijlage 1 |
| 11.38 | Niet-naleving binnen Laboratoriumonderzoek TS4.1; 2.0, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0, 11.0, 12.0, 13.0, 14.0 |
| 11.39 | Niet-naleving binnen Geregistreerde laboratoria TS4.2; 2.0, 3.0, 4.0, 5.0 |
Appendix 5: Verantwoordelijkheid voor de verwerking van gegevens in de GMP+ database en/of recht tot publicatie
| Verantwoordelijk voor: | Artikel | GMP+ Int. | CI/Critical Location |
| Publicatie van CI/Critical Location | 4.2.5 | X | - |
| Publicatie van een geschorste CI/Critical Location | 5.5 | X | - |
| Publicatie van de beëindiging van het GMP+ Feed Certification scheme License Agreement | 5.5 | X | - |
| Publicatie van het niet vernieuwen van het GMP+ Feed Certification scheme License Agreement door GMP+ International | 5.5 | X | - |
| Publicatie dat een andere CI de verplichtingen overneemt, wanneer de oorspronkelijke CI is geschorst | 5.5 | X | - |
| Het informeren van de betrokken GMP+ gecertificeerde bedrijven, wanneer de acceptatie van een CI is ingetrokken/niet vernieuwd is. | 5.5 | X | - |
| Publicatie van een geschorst bedrijf | 5.3 (CR2.0) | X | - |
| Publicatie van het intrekken van een GMP+ Certificaat van een bedrijf vanwege niet-naleving
| 5.3 (CR2.0) | X | - |
| Verantwoordelijk voor: | Artikel | GMP+ Int. | CI/Critical Location |
| De verwerking van gegevens van GMP+ Gecertificeerd Bedrijf (bezoekadres) die gepubliceerd worden op het openbare gedeelte van de GMP+ portal | |||
| Officiële naam van GMP+ gecertificeerd bedrijf | 4.3.7.1 | - | X |
| Straat | 4.3.7.1 | - | X |
| Nummer | 4.3.7.1 | - | X |
| Postcode | 4.3.7.1 | - | X |
| Stad | 4.3.7.1 | - | X |
| Land | 4.3.7.1 | - | X |
| Wettelijk bedrijfsregistratienummer / nummer Kamer van Koophandel | 4.3.7.1 | - | X |
| Telefoonnummer | 4.3.7.1 | - | X |
| E-mailadres | 4.3.7.1 | - | X |
| Website | 4.3.7.1 | - | X |
| Naam van het schip | 4.3.7.1 | - | X |
| EU-nummer | 4.3.7.1 | - | X |
| De verwerking van gegevens van GMP+ Gecertificeerd Bedrijf (postadres) die gepubliceerd worden op het openbare gedeelte van de GMP+ portal | |||
| Postbusnummer | 4.3.7.1 | - | X |
| Postcode | 4.3.7.1 | - | X |
| Stad | 4.3.7.1 | - | X |
| Land | 4.3.7.1 | - | X |
| De certificeringsgegevens van GMP+ Gecertificeerd Bedrijf die deels gepubliceerd worden op het openbare gedeelte van de GMP+ portal | |||
| Scope(s) |
| - | X |
| Gecertificeerd sinds |
| - | X |
| Startdatum van het certificaat |
| - | X |
| Einddatum |
| - | X |
| Datum schorsing (indien van toepassing) |
| - | X |
| Datum van intrekking (indien van toepassing) |
| - | X |
| Reden van schorsing (indien van toepassing) |
| - | X |
| Datum van opgeheven schorsing |
|
| X |
| Reden van intrekking (indien van toepassing) |
| - | X |
| Certificatiestatus |
| - | X |
| Audittijdreductie | | - | X |
| Verantwoordelijk voor: | Artikel | GMP+ Int. | CI/Critical Location |
| De certificeringsgegevens van GMP+ Gecertificeerd Bedrijf die deels gepubliceerd worden op het openbare gedeelte van de GMP+ portal | |||
| Koppelen/ontkoppelen van een multi-site locatie/tractionair aan het hoofdkantoor/ opdrachtgever |
| X | - |
| Contactpersoon bij GMP+ gecertificeerd bedrijf |
| - | X |
| Telefoonnummer voor noodgevallen (24 uur per dag, 7 dagen per week) |
| - | X |
Appendix 6: GMP+ Feed Certification scheme License Agreement
Deze Appendix bevat het model van de licentieovereenkomst die door GMP+ International word gebruikt om de GMP+ Feed Certification scheme License Agreement te sluiten met elke Certificatie Instelling zoals vermeld in artikel 3 van F0.1 Rechten en Plichten.
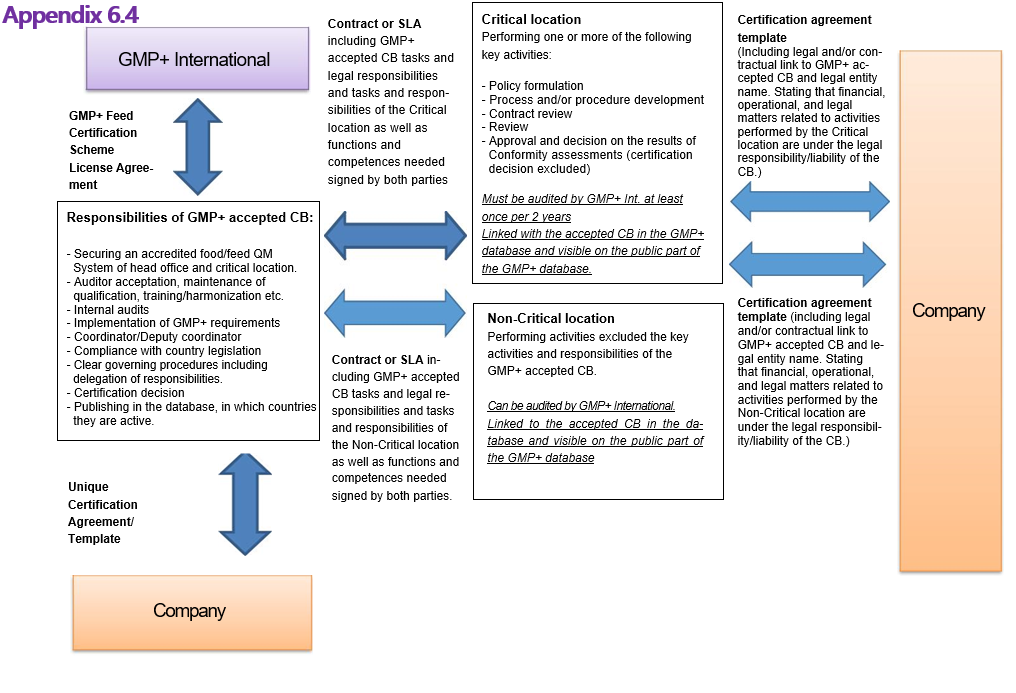
Het doel van dit document is om een wettelijk kader te bieden aan alle partijen die betrokken zijn bij het GMP+ Feed Certification scheme, gevisualiseerd in Appendix 6.4 van dit document. Om transparantie voor alle betrokken partijen mogelijk te maken zijn de volgende hoofddoelstellingen vastgesteld:
- het tot stand brengen van een contractuele relatie, beginnend bij GMP+ International tot en met het GMP+ gecertificeerde bedrijf;
- compliance assessment richting Certificatie Instellingen kan alleen worden uitgevoerd door GMP+ International auditoren.
Om dit vast te stellen zijn de criteria in dit document zoveel mogelijk gebaseerd op internationale standaarden met inbegrip van de GMP+ voorwaarden.
Appendix 6.1: Model agreement
The following text must be used for the GMP+ Feed Certification scheme License agreement (hereinafter License Agreement) between GMP+ International and an accepted Certification Body.
Beginning (model) agreement:
__________________________________________________________________________________________________
The undersigned:
- The Dutch law limited liability company GMP+ International BV, with its registered office at the Braillelaan 9 in (2289 CL) Rijswijk (The Netherlands), registered at the Trade Register of the Dutch Chamber of Commerce under number 27364542,
(hereinafter: “GMP+ International”),
and
- [Name of the certification body], with its registered office at the [address, including country], registered at the [official name of local trade register where the entity is registered] under number [ ],
(hereinafter: “Certification Body”),
(hereinafter collectively referred to as “the Parties”)
Whereas:
- GMP+ International is the holder of rights to the GMP+ Feed Certification scheme, an international certification scheme covering the animal feed chain, consisting of the GMP+ Feed Safety Assurance Module for the assurance of feed safety and the GMP+ Feed Responsibility Assurance Module for the assurance of feed responsibility.
- The GMP+ Feed Safety Assurance Module integrates a variety of feed safety requirements into one module, such as requirements for the feed safety management system, HACCP, product standards, traceability, monitoring, prerequisites programs, chain approach and the Early Warning System. The GMP+ Feed Responsibility Assurance Module incorporates requirements for production, trade, storage & transshipment, and transport of feed products with respect for humans, animals and the environment;
- GMP+ International holds rights to the Licensed IP, (definitions are described in Article 1 below);
- The certification of the GMP+ Feed Certification scheme is not performed by GMP+ International but by licensed Certification Bodies. Companies wishing to obtain GMP+ Feed Certification scheme certification directly approach such a licensed certification body;
- The Certification Body is involved in the certification and is interested in obtaining a License Agreement to perform certification according GMP+ Feed Certification scheme and using the Trademarks, Logos and Documentation;
- GMP+ International is interested in granting the Certification Body a License Agreement, with the aim to allow the Certification Body to certify companies complying with the scope(s) of the GMP+ Feed Certification scheme.
Now it is agreed between the Parties as follows:
- Definitions
For the purpose of this Agreement, the definitions in the GMP+ Feed Certification scheme are applicable. See F0.2 Definition list, the Feed Safety Assurance module and the Feed Responsibility Assurance module.
In addition or notwithstanding, the following terms and definitions shall have the meaning within the framework of this Agreement as set forth below:
1.1 Appendix(es): the Appendixes attached to this agreement which form an integral part of this agreement and have been separately initialed by the Parties and in which the agreements between the Parties have been detailed.
1.2 Basic payment: an annual payment, consisting of two components: a) a basic tariff, and use of database web application and API and b) a variable payment depending on the number of scope(s) and kind of activities of the Certification Body, and if applicable, its Critical Location and the GMP+ Certified Companies by the Certification Body.
1.3 Critical Location: a location of Certification Body conducting one or more key activities (for definition key activities see Chapter 3 F0.2 Definition list.
1.4 Documentation: any documentation provided to the Certification Body by GMP+ International during the term of the License Agreement, including but not limited to the documents of the GMP+ Feed Certification scheme.
1.5 GMP+ Certified Company Emergency Telephone Number: a telephone number of the GMP+ certified company which can be reached 24/7 and 365 days of the year in case of emergencies.
1.6 GMP+ Company Database: a publicly accessible database administered by GMP+ International and actualized by GMP+ International, Certification Bodies and/or Critical Location containing details of the Certification Bodies, Critical Locations and GMP+ Certified Companies.(See Appendix 5 of this document)
1.7 Licensed IP: Trademarks, Logos and the Documentation.
1.8 Logos: any logo of GMP+ International that is protected or not by a trademark in the countries of activity of the users. See chapter 5 of F0.1 Rights and Obligations.
1.9 Measure(s): has the meaning as defined in article 5.5 of this document.
1.10 Non-Critical Location; a location of a Certification Body conducting no key-activities.
1.11 Sanction(s): has the meaning defined in Article 5.5 of this document.
1.12 Suspension: the Certification Body is temporarily suspended for a maximum period of 3 months, if GMP+ International rules that the Certification Body’s is in breach of this License Agreement and therefore denied the rights arising from this License Agreement. This suspension automatically results that Critical Location and Non-Critical Location not being allowed to conduct any GMP+ activities for the same period. All remaining requirements and obligations are stated in Article 5.5 of this document. All remaining requirements and obligations are stated in Article 5.5 of this document.
1.13 Termination: To terminate the License Agreement under the conditions as set out in GMP+ Feed Certification scheme.
1.14 Trademarks: the trademarks licensed to GMP+ International, listed in Appendix 6.2 of this document.
1.15 Website: GMP+ International’s website www.gmpplus.org.
- The GMP+ Feed Certification scheme
2.1 Upon signing of this License Agreement, the Certification Body guarantees that it implements and complies with all applicable requirements in the GMP+ Feed Certification scheme. Parties agree that the most recent version of the GMP+ Feed Certification scheme is integral part of this License Agreement.
2.2 The most recent version of the GMP+ Feed Certification scheme is publicly accessible at the Website www.gmpplus.org of GMP+ International. Upon request of the Certification Body, GMP+ International shall promptly provide the Certification Body with a free copy of the most recent version of the GMP+ Feed Certification scheme, electronically or otherwise. By signing this License Agreement, the Certification Body expressly agrees to the above ways to take note of the GMP+ Feed Certification scheme and declares that prior to signing this License Agreement it has read and understood these documents.
2.3 GMP+ International may at any time amend the GMP+ Feed Certification scheme. GMP+ International shall promptly, electronically or otherwise, notify the Certification Body of amendments to the GMP+ Feed Certification scheme. The certification body must comply with the amendments of this requirements within a period, as mentioned in the S9.1 List of changes GMP+ FC scheme 2020, unless GMP+ International determines a shorter period.
2.4 Upon signing of this License Agreement the Certification Body and its Critical Location(s) must have the required accreditation (see article 4.3.1 of this document).
2.5 The Certification Body must provide full cooperation to GMP+ International in the accurate implementation of the GMP+ Feed Certification scheme.
2.6 GMP+ International is allowed to conduct Compliance Assessments at the premises of the Certification Body and its, Critical-, Non-Critical Location(s) as well as at the GMP+ Certified Companies. The Certification Body and its Critical-, Non-Critical Location(s) must lend its full cooperation to such Compliance Assessments. See article 5 of this document.
2.7 GMP+ International shall, as far as reasonably possible, enable the Certification Body to give advice with respect to proposed changes to the GMP+ Feed Certification scheme via its public consultation procedure and the GMP+ Subcommittee Certification & Compliance.
2.8 The Certification Body has the right to nominate candidates to represent all Certification Bodies for membership of the GMP+ Subcommittee Certification & Compliance.
2.9 The Certification Body can only delegate key activities to Critical Location(s) and non-key activities to Non-Critical Location(s) by means of a Contract or a Service Level Agreement (SLA).
2.10 The Certification Body shall keep proper records of Contracts and/or SLA established between the Critical/Non-Critical Location(s), and shall have these records readily available for assessment by GMP+ International during a Compliance Assessment.
2.11 The Certification Body must inform GMP+ International immediately in case a Critical/Non-Critical Location is in breach of the Contract and/or SLA.
- Grant of license
3.1 Subject to the terms and conditions of the License Agreement, GMP+ International grants and the Certification Body accepts, a non-exclusive license to certify companies complying with the scope(s) of the GMP+ Feed Certification scheme.
3.2 Subject to the terms of the License Agreement, GMP+ International allows the Certification Body to use the GMP+ Logo/Trademarks as further set out in F0.1 Rights and Obligations. The right to use the GMP+ Logo/Trademarks can exclusively be granted by GMP+ International. The right to use the GMP+ Logo/Trademark can be withdrawn if the Certification Body does not comply with the requirements as set out in the GMP+ Feed Certification scheme and fails to remedy the same within the determined timeframe.
3.3 The Documentation shall not be published nor modified in any way by the Certification Body. The Certification Body has the right to reproduce the Documentation for its own use or, subject to the conditions of the License Agreement, to make it available to the GMP+ Certified Companies.
3.4 The Certification Body has the duty to immediately report to GMP+ International any infringement of the Licensed IP which comes to the notice of the Certification Body.
3.5 GMP+ International shall always have the right to sue in respect of infringement of the Licensed IP without the Certification Body, at its own expense and under its sole liability, and to earn exclusively the results of the proceedings.
3.6 The Certification Body must perform and document its internal audits (at the Critical Location) to be conducted every 12 months.
3.7 The Certification Body is responsible to comply with the applicable country legislation were the Certification Body is located.
3.8 The Certification Body is responsible for:
- the certification decision;
- auditor acceptation, maintenance of qualification, training etc.;
- clear governing procedure including delegation of responsibilities;
- have a GMP+ coordinator/ deputy connected to the location and the certification body.
- Certification and auditing of Companies
4.1 The Certification Body shall conclude a unique Certification Agreement and/or Certification agreement template with a Company before conducting an Initial (Certification) Audit. During the validity of a GMP+ certificate, the Certification Body must conduct audits at the GMP+ Certified Company in accordance with the GMP+ Feed Certification scheme.
4.2 After the decision of the Certification Body, the Certification Body/Critical Location shall have the right to issue Certificates to Companies for the scopes specified in Appendix 6.3.
4.3 The Critical/Non-Critical Locations may offer GMP+ International’s activities to the local market only on behalf of the Certification Body which must always mention the name and logo of the Certification Body.
4.3.1 In the standardized certification agreement signed on behalf of the Certification Body in the form of a template approved by the Certification Body, between the Critical/Non-Critical location and the Company a legal or contractual link to the Certification Body and legal entity name must be included, stating the financial-, operational- and legal matter related to activities performed by the Critical/Non-Critical location are under the liability of the Certification Body.
4.3.2 The reports issued to the GMP+ Certified Company shall contain the name and address of the GMP+ International accepted Certification Body without the logo of the Critical and/or Non-Critical Location. However the report may make reference to the contact details of the Critical and/or Non-Critical Location issuing the report in question.
4.3.3 The certificate issued to the GMP+ Certified Company shall contain the name and address of the Certification Body without the logo of the Critical Location. However the certificate may make reference to the contact details of the Critical Location issuing the certificate in question. The certificate issued shall not create any confusion as to the Certification body.
4.4 The Certification Body, Critical/Non-Critical Location is obliged to keep proper records of unique- and/or standardized Certification Agreement in the form of a template approved by the Certification Body, and results and reports of the Audits at GMP+ Certified Companies and the certificate and is obliged to have these records readily available in the global quality management system for Compliance assessment by GMP+ International. In case GMP+ International wants to receive (copies of) records, the Certification Body, Critical/Non-Critical Location is obliged to make the requested information available to GMP+ International accordingly.
4.5 The Certification Body must inform GMP+ International immediately in case a GMP+ Certified Company is in breach of the Certification Agreement with respect to conditions and obligations arising from the GMP+ Feed Certification scheme.
4.6 GMP+ International has the right, at any time, to conduct a Compliance Audit of the GMP+ Certified Company or to participate as witness during an Audit. The cost of these audits is at the expense of GMP+ International.
- Confidentiality
5.1 The Certification Body must not disclose to third parties any Documentation, or use it for any purpose other than as described herein, unless GMP+ International agrees otherwise prior to disclosure in writing.
5.2 Non-disclosure obligations arising from Article 5.1 shall not apply to Documentation the contents of which have become generally known or easily accessible or which have been lawfully revealed by a third party. In case to comply with law and/or legal regulation and/or by orders of a court, governmental agency but always with prior notice to GMP+ International.
5.3 The Certification Body must procure that all of its employees and Critical/Non-Critical Location and their employees, if any, adhere to the obligations arising out of Article 5.1.
5.4 With exception of the cases of authorization mentioned in the GMP+ Feed Certification scheme, GMP+ International shall not disclose to third parties any information of the Certification Body and will not use it for any purpose other than as described herein, unless the Certification Body agrees otherwise prior to disclosure in writing.
- Fees
6.1 Every year, the Certification Body must pay to GMP+ International the Basic payment. The amounts hereof are specified in the CR4.0 Tariffs document of the GMP+ Feed Certification scheme. The amounts specified therein are agreed net. If VAT is applicable, this shall be borne by the Certification Body. Any local and/or other taxes, governmental fees or dues, if applicable, shall also be borne by the Certification Body.
Every year, the Critical Location must pay to GMP+ International a fixed Payment as establish in article 2.2 of the CR4.0 Tariffs.
6.2 The Basic payment is determined by GMP+ International. GMP+ International reserves the right to unilaterally adjust the amounts in the CR4.0 Tariffs of the GMP+ Feed Certification scheme.
6.3 The Certification Body/Critical Location must keep the GMP+ company database up to date as mentioned in Appendix 5 of this document in order to enable GMP+ International to extract the necessary information required to calculate the Basic Payment.
6.4 In addition to the Basic payment, the Certification Body hereby agrees to pay GMP+ International a fee for the examination by GMP+ International of its auditors. The amounts hereof are specified in the GMP+ CR4.0 Tariffs of the GMP+ Feed Certification scheme. The amounts specified therein are agreed net. If VAT is applicable, this shall be borne by the Certification Body. Any local and/or other taxes, governmental fees or dues, if applicable, shall also be borne by the Certification Body.
- GMP+ Company Database
7.1 The Certification Body must comply with the (applicable) requirements and obligations as stated in Article 4.3.7.1. of this document which is an integral part of this agreement.
- Default
8.1 In the event the Certification Body, Critical/Non-Critical Location is not or not fully performing one or more of the obligations arising from this Agreement, including but not limited to obligations arising from the GMP+ Feed Certification scheme measures and sanctions as stated in Article 5.5 of this document, which is an integral part of this agreement,will be imposed.
- Conditions for the GMP+ accepted Certification Body operating with Critical and Non-Critical Location(s).
9.1 The Certification Body and its Critical and Non-Critical Location must operate under the same management and the same digital global quality management system accessible for all locations.
9.2 The Certification Body shall have the means to substantially influence and control the activities of the locations. The Certification Body shall be able to demonstrate that such influence and control is in place and properly working.
9.3 The Certification Body maintains the final responsibility for the GMP+ International activities performed by the Critical, Non-Critical Location.
9.4 Where the Critical Location(s) carry out key activities then the GMP+ International accepted Certification Body shall in its contract and/or SLA clearly identify the address of these locations.
9.5 The use of Critical and/or Non-Critical Locations is only allowed for locations within the same organization and where the Certification Body maintains the legal responsibility for the activities performed and certificates/reports issued by the Critical and/or Non-Critical Locations. The legal responsibility must be demonstrated on the basis of contract/SLA or equivalent legal relationships between the Certification Body and the Critical and/or Non-Critical Locations and internal regulations in the organization that further specify these relationships in terms of management and legal responsibilities.
9.6 Using Critical and/or Non-Critical Locations is possible for all types of locations such as subsidiaries, branches, agencies, offices, etc. regardless of their legal personality, as long as they carry out clearly defined and relevant activities within the scope(s) of the GMP+ Feed Certification scheme.
9.7 Holding the final responsibility as mentioned in article 9.4 for activities performed by the Critical and/or Non-Critical Location, implies that the Certification body takes the operational, financial and legal responsibility/liability for activities performed by these locations, and this operational, financial and legal responsibility/liability must be stated in the GMP+ certification agreement with its customers.
- Duration and termination
10.1 This Agreement will enter into force on the dd.mm.yyyy if signed by the Parties and will remain in force until dd.mm.yyyy.
10.2 GMP+ International is entitled to terminate this Agreement with immediate effect by written notice to the Certification Body if:
- the Certification Body does not comply with the binding instructions issued by GMP+ International as stated in Article 2/4f of F0.1 Rights and Obligations.
- the Certification Body has no accredited food/feed quality management system.
- the Certification Body does not or not fully perform one or more of the essential of its obligations arising from the GMP+ Feed Certification scheme.
10.3 Either Party may terminate or not to renew this Agreement with immediate effect by written notice to the other Party if:
- either Party commits any breach of any of the provisions of this Agreement and, in the case of a breach capable of remedy, fails to remedy the same within a determined timeframe after receipt of an official letter giving full particulars of the breach and require corrective actions;
- an encumbrance takes possession or a receiver is appointed over any of the property or assets of that other Party or is declared bankrupt;
- that other Party makes any voluntary arrangement with its creditors or becomes subject to an administration order;
- that other Party goes into liquidation;
- anything which, under the law of any jurisdiction, is analogous to any of the acts or events specified in clauses 10.3 a)-d) of this Agreement; or
- that other Party ceases, or threatens to cease, to carry on business.
10.4 In the event that a Certification Body terminates or not to renew the License Agreement they are obliged to inform all parties concerned three months in advance to enable all Participants to transfer to another Certification Body.
- Liability
11.1 The Certification Body shall reimburse GMP+ International for the principal amount of a claim for compensation or damages by a GMP+ Certified Company and/or a Company directed at GMP+ International insofar as GMP+ International’s liability towards the GMP+ Certified Company and/or the Company is related to the performance of the Certification Agreement by the Certification Body and subsequently its Critical/Non-Critical Location and on the condition that such liability has been established by a final court judgment or final arbitral award.
11.2 The indemnity as set out in Article 11.1 does not apply if:
- A claim directed at GMP+ International is based on acts of GMP+ International itself (including but not limited to use of the binding instruction, a violation by GMP+ International of the GMP+ scheme or external communication by GMP+ International)
- Or the claim is based on such facts or circumstances as the Certification Body and subsequently its Critical/Non-Critical Location did not know or could not have been expected to know and taken into account at the time of the performance of the Certification Agreement.
11.3 The indemnity as set out in Article 11.1 applies nonetheless if an act of GMP+ International as set out in Article 11.2 is due to GMP+ International having based its conduct on incorrect information provided by the Certification Body and/or Critical/Non-Critical Location (and the Certification Body and/or Critical/Non-Critical Location knew or should have known that it was incorrect).
11.4 In case of a claim within the scope of this Article 11, GMP+ International shall forthwith fully inform the Certification Body and not enter into an amicable settlement with claimant without prior written consent of the Certification Body, on penalty of forfeiture of the rights under this Article 11.
11.5 The Certification Body shall at all times be fully liable towards GMP+ International for all acts and omissions by its Critical/Non-Critical Location.
11.6 The liability of parties towards each other in connection with performance of this Agreement and this Article 11 is at all times limited to € 250,000 per claim with a maximum of € 1,000,000 per calendar year.
- Miscellaneous
12.1 This Agreement constitutes the complete and full agreement between the Parties and includes Appendix 6.2, 6.3 and 6.4.
12.2 Any invalidity of individual provisions of this Agreement shall not affect the validity of the remaining provisions of this Agreement. The remaining provisions of this Agreement shall remain in full force and effect and enforceable to the fullest extent permitted by law. Any provisions found to be invalid or unenforceable shall be substituted by such other provisions coming, in a legally permissible way, as close as possible to the economic meaning and intention of such invalid provision.
12.3 The Certification Body is not allowed to assign this Agreement in whole or in part or any benefit or interest therein.
- Applicable law and disputes
13.1 This Agreement shall be governed by and construed in accordance with the laws of The Netherlands.
13.2 All disputes arising in connection with the Agreement, or further contracts resulting therefrom, shall be heard by the District Court of Rotterdam, having exclusive jurisdiction.
Drawn up and signed in duplicate,
| GMP+ International BV | [Name Certification Body] |
| Managing Director | [Name of legal representative] (Title of legal representative) |
| …………………………… (Signature) | ……………………………… (Signature) |
| Place: Rijswijk | Place: ………………………… |
| Date: ……………………… | Date: …………………………. |
Appendix 6.2: Trademarks and Logo’s
Trademarks and applicable logo(s) will be added in individual Agreement(s)
The trademarks have been protected globally. For instance, GMP+ International is the owner of the following registrations:
GMP+ FSA word mark: Benelux, EU and international registrations
GMP+ FSA logo: Benelux, EU, UK and international registrations
GMP+ FRA logo: EU and UK registrations
A complete overview of the list will be shared upon request.
Appendix 6.3: Scopes covered by the GMP+ Feed Certification scheme (License) Agreement
This document is part of the GMP+ Feed Certification scheme License Agreement which has been entered into force <date><month><year> for the period until <date><month><year> between GMP+ International and
| Name of the Certification Body | : | |
| Address | : | |
| Location | : | |
The GMP+ Feed Certification License Agreement will relate to the following scopes of the GMP+ Feed Certification scheme with effect from the date specified below:
| GMP+ scopes | Accepted / |
| Production of compound feed | |
| Production of compound feed | |
| Production of compound feed – petfood | |
| Production of premixtures | |
| Production of premixtures | |
| Production of feed additives | |
| Production of feed additives | |
| Production of feed materials | |
| Production of feed materials | |
| Production of feed materials – petfood | |
| Trade | |
| Trade in feed | |
| Trade in feed – petfood | |
| Trade to livestock farms | |
| Storage and Transshipment | |
| Storage and Transshipment of feed | |
| Transport | |
| Road transport of feed | |
| Rail transport of feed | |
| Inland waterway transport and short sea shipping of feed | |
| Affreightment | |
| Affreightment of short sea shipping | |
| Affreightment of inland waterway transport | |
| Affreightment of sea transport | |
| Affreightment of rail transport | |
| Affreightment of road transport | |
| Laboratories | |
| Laboratory testing | |
| Registered laboratory | |
| Additional scopes | |
| Antibiotics-free production site | |
| Dioxin-monitoring in feed for laying hens | |
| QM-Milch | |
| FRA scopes | |
| RTRS | |
| Responsible dairy feed | |
| Responsible pig & poultry feed | |
| Production of compound feed – GMO controlled | |
| Production of premixtures – GMO controlled | |
| Production of feed additives – GMO controlled | |
| Production of feed materials – GMO controlled | |
| Trade in feed – GMO controlled | |
| Storage and Transshipment of feed – GMO controlled | |
| Road transport of feed – GMO controlled | |
| Carbon footprint of feed | |
| Responsible feed | |
Valid from <date of signature>
Valid until: <date><month><year>
GMP+ International B.V.
Managing Director
[Name Certification Body]
…………………………….
[Name of legal representative]
Managing Director
……………………………
(Signature)
………………………………...
Date:………………………
Appendix 6.4: Contractuele schakels