1. Scope van dit document
Dit document bevat de beoordelings- en certificeringscriteria voor het uitvoeren van audits bij de aanvragende organisaties/GMP+ gecertificeerde bedrijven die leiden tot (her)certificering voor de GMP+ Feed Certification scheme, Feed Safety Assurance (FSA)-module.
2. Normatieve verwijzing(en)
Er wordt naar de volgende documenten, geheel of gedeeltelijk, in dit document normatief gerefereerd en moeten verplicht worden nageleefd. Voor gedateerde referenties is alleen de geciteerde editie van toepassing. Voor ongedateerde referenties is de laatste editie van het document waarnaar wordt verwezen (inclusief eventuele wijzigingen) van toepassing.
- ISO/IEC 17021-1:2015 Conformiteitsbeoordeling - Eisen voor instellingen die audits en certificatie van managementsystemen leveren.
- ISO 22003-1:2022(E) Eisen voor organisaties die audits en certificatie aanbieden van voedselveiligheidmanagementsystemen.
- IAF MD 2:2017 - IAF Verplicht document voor de overdracht van geaccrediteerde certificatie van managementsystemen
- IAF MD 5:2019 - Bepaling van de audittijd van managementsystemen voor kwaliteit, omgeving, gezondheid en veiligheid op het werk.
- ISO/IEC 17020:2012 Conformiteitsbeoordeling - Eisen voor het functioneren van verschillende soorten instellingen die keuringen uitvoeren.
- ISO/IEC 17025:2017 Algemene eisen voor de competentie van beproevings- en kalibratielaboratoria.
- F0.1 Rechten en plichten.
- F0.2 Definitielijst.
- F0.3 Scopes voor certificatie.
- CR1.0 Acceptatievoorwaarden.
- CR3.0 Beoordeling en Certificering van Feed Responsibility Assurance scopes.
- GMP+ Feed Safety Assurance Module 2020.
3. Termen en Definities
Voor GMP+ definities zie F0.2 Definitielijst. In dit gehele document wordt de terminologie "via de Certificatie Instelling" gebruikt om aan te geven dat alle activiteiten die door critical, non-critical locations worden uitgevoerd onder de verantwoordelijkheid/aansprakelijkheid van de door GMP+ geaccepteerde Certificatie Instelling vallen.
4. Principes
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Hoofdstuk 4 |
5. Procesvoorwaarden
5.1. Pre-certificeringsactiviteiten
5.1.1. Aanvraag
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.1.1 |
Daarnaast zijn relevante gegevens over de aanvragende organisatie, zoals genoemd onder 9.1.1. B) van de ISO/IEC 17021-1:2015:
- Poortwachtersdossiers,
- Multi-site certificering,
- Aantal werknemers,
- Aantal producten.
- Een geactualiseerde groepsstructuur van de aanvragende organisatie, met inbegrip van de uiteindelijke begunstigde eigenaar en een directieoverzicht, alsmede een verklaring waarin de aanvragende organisatie, de uiteindelijke begunstigde eigenaar of de betrokkenheid van de directie bij bedrijven die vergelijkbaar zijn met het bedrijf van de aanvragende organisatie worden vermeld, om te bevestigen dat de aanvragende organisatie voldoet aan hoofdstuk 5 van de F0.1 Rechten en Plichten.
En indien van toepassing:
- Aantal analyses;
- Geaccrediteerde analyses;
- Gedeeltelijk geaccrediteerde analyses;
- Niet geaccrediteerde analyses.
5.1.2. Beoordeling van de aanvraag
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.1.2 |
Daarnaast:
- Beschrijving van activiteiten en/of processen die tijdens een audit door de Certificatie Instelling moeten worden beoordeeld.
- De scope van de certificering mag niet misleidend zijn.
5.1.3. Certificatieovereenkomst
Alvorens een initiële certificeringsaudit/inspectie uit te voeren moeten de Certificatie Instelling en de aanvragende organisatie een wettelijk afdwingbare unieke certificatieovereenkomst afsluiten en gedurende de geldigheid van een GMP+ certificaat/tijdelijke acceptatie blijft deze wettelijk afdwingbare unieke certificatieovereenkomst van kracht.
De certificatieovereenkomst die wordt afgegeven door een critical/non-critical location moet voldoen aan de door de betreffende Certificatie Instelling goedgekeurde template.
De Certificatie Instelling moet zich ervan bewust zijn dat:
- De certificatieovereenkomst altijd moet worden afgesloten met de wettelijke entiteit die van toepassing is.
- Deze overeenkomsten moeten worden afgesloten voor het aangeven en beschrijven van de van toepassing zijnde certificatieactiviteiten in overeenstemming met het GMP+ Feed Certification scheme.
- Het niet is toegestaan om voorwaarden in de certificatieovereenkomst vast te leggen die in strijd zijn met de GMP+ voorwaarden.
- Het is niet toegestaan om aan de aanvragende organisatie/GMP+ gecertificeerde bedrijf andere voorwaarden te stellen en op te leggen dan die welke in het GMP+ Feed Certification scheme zijn gespecificeerd, tenzij dit in de interne procedure van de GMP+ gecertificeerde bedrijven is vastgelegd.
De volgende GMP+ specifieke voorwaarden moeten in de certificatieovereenkomst worden vastgelegd:
- De van toepassing zijnde scope(s)/module die de GMP+ certificatie dekken.
- De minimaal verplichte audittijden per scope(s)/modules per type audit/inspectie zoals vermeld in Appendix 2; verwijzen naar Appendix 2 is onvoldoende. Het is niet toegestaan om af te wijken van de minimaal verplichte audittijden door middel van facturering op basis van herberekening. Indien een langere audittijd van toepassing is, kan dit in overleg met de aanvragende organisatie/GMP+ Gecertificeerd Bedrijf gebeuren. In geval van Multi-site certificering zijn de minimaal verplichte audittijden zoals vermeld in Appendix 4 van toepassing.
- Elke multi-site locatie moet vastgelegd zijn met zijn GMP+ registratienummer en de van toepassing zijnde minimaal verplichte audittijd per type audit zoals vermeld in Appendix 4; verwijzing naar Appendix 4 is onvoldoende.
- Het gebruik van het GMP+ logo in overeenstemming met de F0.1 Rechten en Plichten.
- De bepaling (indien van toepassing), dat in geval van een vastgestelde non-conformity van een toegestaan niveau van een besmetting, het GMP+ gecertificeerde bedrijf verplicht is een EWS-melding te doen conform de R1.0 Feed Safety Management Systems Requirements.
- De verplichte medewerking van de aanvragende organisatie/GMP+ Gecertificeerd Bedrijf met ad-hoc audit (zoals vermeld in F0.1 Rechten en Plichten) witness audits en, parallel audits (zoals vermeld in CR 1.0 Acceptatievoorwaarden).
- Het doorsturen van auditrapporten/audit checklijsten naar GMP+ International.
- De mogelijkheid om de certificatieovereenkomst voor het einde van de certificatiecyclus te beëindigen.
- Indien van toepassing, de onaangekondigde audit (zie artikel 5.2.1.4.2 van dit document).
- De mogelijkheid in geval van een onbevredigende beroepsprocedure dat het GMP+ gecertificeerde bedrijf de F0.5 Geschillenprocedure kan toepassen.
5.1.4. Toewijzen van het auditteam
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.2.2 |
Met betrekking tot artikel 9.2.2.1.2 is de aanvullende voorwaarde zoals vermeld in artikel 4.3.6 van de CR 1.0 Acceptatievoorwaarden van toepassing.
5.1.4.1. Rotatie van auditoren/inspecteurs
Een auditor mag niet meer dan drie opeenvolgende jaren aan hetzelfde GMP+ gecertificeerde bedrijf worden toegewezen. Indien er geen alternatieve auditor beschikbaar is, kan de Certificatie Instelling een uitzondering maken en kan de periode verlengd worden met maximaal drie opeenvolgende jaren. De beslissing moet gemotiveerd en gedocumenteerd worden.
Rotatie van auditoren/technisch expert scope geregistreerd laboratorium:
- De auditor en technisch expert mogen de desk study van hetzelfde GMP+ gecertificeerde bedrijf maar zes keer achter elkaar uitvoeren. Daarna moeten de auditor en technisch expert worden geroteerd.
Rotatie van inspecteur:
- Na drie opeenvolgende inspecties moet een nieuwe inspecteur worden toegewezen.
5.1.5. Auditplan
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.2.3 |
Daarnaast moet de aanvragende organisatie/GMP+ gecertificeerd bedrijf op verzoek van de Certificatie Instelling de volgende documentatie verstrekken:
- Organisatieschema en korte procesbeschrijvingen,
- Lijst van GMP+ geborgde producten,
- Informatie over de productielocatie en/of onderaannemers,
- Het FSMS-handboek op locatie tijdens de audit (papieren of elektronische versie).
- Lijst van toepasselijke voorschriften,
- Alle andere informatie die de auditor/eigenaar van het bedrijf nuttig/relevant kan vinden.
De selectie van al het relevante personeel dat moet worden geïnterviewd, moet elk relevant functioneel gebied adequaat bestrijken.
Voor de surveillance- of hercertificatieaudit moet het GMP+ gecertificeerde bedrijf de volgende documentatie/informatie aan de Certificatie Instelling verstrekken:
- Veranderingen in de organisatie,
- Veranderingen in het FSMS-handboek,
- Wijzigingen in de toepasselijke wetgeving,
- Scope-informatie,
- En alle andere informatie die relevant is.
Een audit plan is niet van toepassing voor de scope Binnen- en kustvaarttransport van diervoeder.
5.2. Certificeringsproces
5.2.1. Audits/inspecties
5.2.1.1. Algemeen
Een door GMP+ International geaccepteerde Certificatie Instelling in het kader van het GMP+ Feed Certification scheme heeft het recht om via de Certificatie Instelling bedrijven te certificeren die geïnteresseerd zijn in 1 of meer GMP+ scopes voor de diervoedersector, zoals gespecificeerd in het GMP+ Feed Certification scheme.
De aanvragende organisatie/GMP+ gecertificeerd bedrijf moet volledig meewerken aan audits zoals gespecificeerd in dit document. Tijdens de audits/inspecties moet het proces waarvoor het bedrijf is gecertificeerd operationeel zijn om te kunnen worden geverifieerd. Het auditen kan het nemen van productmonsters en laboratoriumonderzoek omvatten.
Via de Certificatie Instelling vindt de beoordeling plaats door middel van een audit/inspectie bij de aanvragende organisatie/ het GMP+ gecertificeerd bedrijf op conformiteit van de van toepassing zijnde scope(s) op basis van de algemene voorwaarden zoals gespecificeerd in Appendix 1 en de aanvullende beoordelingscriteria in de checklijsten.
Dit is van toepassing op volgende audits:
- Initiële certificatieaudit (ICA)
- Aangekondigde tussentijdse audit (ASA)
- Onaangekondigde tussentijdse audit (USA)
- Inspectie
- Hercertificatieaudit (RCA)
- Uitbreidingsaudit
- Documenten beoordeling (DA)
Daarnaast:
- De beoordeling voor de scope Geregistreerd laboratorium wordt uitgevoerd door middel van een desk study (of op locatie indien van toepassing).
- De administratieve beoordeling van de scope Laboratoriumonderzoek moet eenmaal per jaar worden uitgevoerd, als alle analyses geaccrediteerd zijn volgens ISO/IEC17025.
- De beoordeling op locatie van de scope Laboratoriumonderzoek moet eenmaal per jaar worden uitgevoerd voor de niet-ISO/IEC 17025 geaccrediteerde analyses, als niet alle analyses zijn geaccrediteerd volgens ISO/IEC17025.
- De beoordeling op locatie van de scope Laboratoriumonderzoek moet eenmaal per jaar worden uitgevoerd voor systeembeoordeling, als het laboratorium niet is geaccrediteerd volgens ISO/IEC17025.
Daarnaast kunnen ook speciale audits worden uitgevoerd (zie artikel 5.2.2.).
De certificatiecyclus heeft een maximale duur van drie jaar. Alle voorwaarden moeten worden beoordeeld tijdens elk van de volgende audits: initiële certificatie-, (on)aangekondigde tussentijdse en hercertificatieaudit. De minimale verplichte audittijden en de frequentie zijn vastgelegd in Appendix 2 en Appendix 4.
Indien een GMP+ gecertificeerd bedrijf tijdens de certificatiecyclus zijn activiteiten en/of locatie verandert, moet het GMP+ gecertificeerde bedrijf via de Certificatie Instelling op locatie worden geaudit.
Dit geldt voor productie, transport en op- en overslag. De GMP+ audittijden zijn van toepassing. Het is de beslissing van de Certificatie Instelling of een initiële certificatie- of tussentijdse audit moet worden uitgevoerd.
5.2.1.2. Openingsgesprek
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.4.2 |
Bovendien niet van toepassing op de scope Binnen- en kustvaarttransport van diervoeder.
5.2.1.3. Initiële certificatieaudit
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.3.1 |
| ISO 22003-1:2022(E) | Artikel 9.3.2 tot en met 9.3.4 |
Een GMP+ certificaat kan al dan niet worden verleend, afhankelijk van hoe aan de beoordelings criteria van dit document is voldaan. Een initiële certificatieaudit fase 1 moet binnen drie maanden na het afsluiten van een certificatieovereenkomst met de aanvragende organisatie worden uitgevoerd. Het interval tussen fase 1 en fase 2 is maximaal vier maanden.
Wanneer aan de specifieke voorwaarden zoals beschreven in Appendix 5 “Niet op de locatie van het GMP+ gecertificeerde bedrijf” en/of Appendix 6 “Audits op afstand” is voldaan, kan de initiële certificatieaudit dienovereenkomstig worden uitgevoerd.
Scope laboratoriumonderzoek:
De belangrijkste analyses moeten worden beoordeeld tijdens de initiële certificatieaudit. Alle analyses moeten tijdens de certificatiecyclus worden beoordeeld.
5.2.1.3.1. Tijdelijke acceptatie
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.3.1.2 |
| ISO 22003-1:2022(E) | Artikel 9.3.2 tot en met 9.3.4 |
Het is mogelijk om op basis van een positieve beoordeling van fase 1 van de documentatie van het feed safety management system een tijdelijke acceptatie (maximaal vier maanden) af te geven als onderdeel van een initiële certificatieaudit bij een bedrijf dat zijn GMP+ activiteiten start.
Ten aanzien van de locatie van de beoordeling geldt het volgende:
- Wanneer een bedrijf productie- en/of opslag- en/of transportactiviteiten uitvoert (tractionairs uitgezonderd), moet een deel van de beoordeling van de kwaliteitsdocumentatie op de bedrijfslocatie(s) plaatsvinden, zodat de infrastructurele voorzieningen kunnen worden beoordeeld.
- Indien het bedrijf andere activiteiten uitvoert, kan een deel van de beoordeling van de kwaliteitsdocumentatie plaatsvinden op de bedrijfslocatie(s) indien de Certificatie Instelling dit noodzakelijk acht.
Het gehele certificatieproces moet binnen de geldigheidsduur van de tijdelijke acceptatie zijn afgerond, inclusief het actualiseren van de GMP+ Bedrijvendatabase (inclusief status en certificaatdata) via de Certificatie Instelling.
Bedrijven die niet in aanmerking komen voor een tijdelijke acceptatie zijn:
- Bedrijven overgestapt van een andere Certificatie Instelling.
- Bedrijven die in het verleden GMP+ gecertificeerd waren of een tijdelijke toelating hadden.
5.2.1.4. Tussentijdse audits
Alle voorwaarden moeten tijdens de tussentijdse audits worden geverifieerd.
De eerste tussentijdse audit moet elke 12 maanden, plus en min twee maanden, na de datum van het certificatiebesluit worden uitgevoerd.
De tweede tussentijdse audit moet elke 24 maanden, plus en min twee maanden, na de datum van het certificatiebesluit worden uitgevoerd.
Wanneer aan de specifieke voorwaarden zoals beschreven in Appendix 5 “Niet op de locatie van het GMP+ gecertificeerde bedrijf” en/of Appendix 6 “Audits op afstand” wordt voldaan, kan de tussentijdse audit dienovereenkomstig worden uitgevoerd.
5.2.1.4.1. Aangekondigde tussentijdse audit
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.6.2 |
5.2.1.4.2. Onaangekondigde tussentijdse audit
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.6.2 |
De Certificatie Instellingen mogen de onaangekondigde tussentijdse audit niet binnen twee maanden voor of na de uitvoering van andere audits (initiële certificatie, hercertificatie en aangekondigde tussentijdse audits) plannen. Elke twaalf (12) maanden van de auditcyclus kan elk GMP+ gecertificeerd bedrijf in dat jaar 15 dagen aangeven gedurende welke de onaangekondigde tussentijdse audit niet kan worden uitgevoerd. Indien niet vooraf aangegeven, kan de onaangekondigde tussentijdse audit niet worden geweigerd. Het is aan de Certificatie Instelling om te beslissen of de legitieme motivatie om de onaangekondigde tussentijdse audit uit te stellen, gerechtvaardigd is.
Voorbeelden van rechtmatig uitstel van de onaangekondigde tussentijdse audit zijn:
- De Certificatie Instelling kan de locatie van het GMP+ gecertificeerde bedrijf niet bezoeken, omdat deze overstroomd is of omdat er andere extreme weersomstandigheden zijn.
- De locatie van het GMP+ gecertificeerd bedrijf is gesloten (jaarlijkse sluiting, onderhoud, vakantie) of de locatie van het GMP+ gecertificeerd bedrijf voert geen GMP+ activiteiten uit (seizoenswerk).
De volgende vooraankondigingstermijnen voor het uitvoeren van de onaangekondigde tussentijdse audit zijn van toepassing:
- GMP+ gecertificeerde bedrijven (producenten) gevestigd in Nederland: niet toegestaan.GMP+ Gecertificeerde Bedrijven (producenten) gevestigd in Duitsland: één werkdag. GMP+ Gecertificeerde Bedrijven (producenten) gevestigd in andere landen in Europa: twee werkdagen.
- GMP+ gecertificeerde bedrijven (producenten) gevestigd buiten Europa: drie werkdagen.
Er zijn verschillende opties:
A: Verplichte onaangekondigde tussentijdse audit
De onaangekondigde tussentijdse audit is verplicht voor GMP+ gecertificeerde bedrijven in Europa die gecertificeerd zijn voor een van de volgende scopes:
- Productie van mengvoeder (incl. huisdiervoeder),
- Productie van voormengsels,
- Productie van toevoegingsmiddelen,
- Productie van voedermiddelen (incl. huisdiervoeder).
De onaangekondigde tussentijdse audit vervangt één van de aangekondigde tussentijdse audits tijdens de certificatiecyclus en moet in de GMP+ Bedrijvendatabase worden geregistreerd.
Optie B: Vrijwillige onaangekondigde tussentijdse audit
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.6.2 |
Degenen die zich aanmelden voor de vrijwillige onaangekondigde audit, zijn verplicht deel te nemen gedurende de gehele certificatiecyclus. De onaangekondigde tussentijdse audit vervangt één van de aangekondigde tussentijdse audits gedurende de certificatiecyclus en moet in de GMP+ Bedrijvendatabase worden geregistreerd.
B1): Voor Europese GMP+ gecertificeerde bedrijven gecertificeerd voor de volgende scope(s):
- Handel in diervoeder,
- Op- en overslag van diervoeder,
- Wegtransport van diervoeder,
- Railtransport van diervoeder,
- Bevrachting (alle scopes),
Europese GMP+ gecertificeerde bedrijven (inclusief GMP+ gecertificeerde bedrijven gevestigd in Nederland en Duitsland) die gecertificeerd zijn voor een van de productiescopes en dus verplicht deelnemen aan de onaangekondigde tussentijdse audit voor de productiescope, kunnen beslissen of ze de onaangekondigde tussentijdse audit ook voor een van de onder optie B1 genoemde scopes willen toepassen.
B2) Voor alle GMP+ gecertificeerde bedrijven buiten Europa die gecertificeerd zijn voor een GMP+ scope.
De onaangekondigde audit kan op vrijwillige basis worden toegepast voor alle scopes in elk land.
5.2.1.5. Inspectie
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17020:2012 | Artikel 7.1 |
Via de Certificatie Instelling wordt een certificatie-inspectie uitgevoerd om te beoordelen of het bedrijf voldoet aan de criteria uit de checklist voor Binnen- en kustvaarttransport. De certificatie-inspectie moet worden uitgevoerd binnen drie maanden na het sluiten van een certificatieovereenkomst met de aanvragende organisatie.
5.2.1.6. Hercertificatieaudit
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.6.3 |
Een GMP+ certificaat kan al dan niet worden verlengd, afhankelijk van hoe aan de beoordelings criteria uit Appendix 1 van dit document of in de GMP+ checklist Binnen- en kustvaarttransport van diervoeder wordt voldaan. Voordat de geldigheidsduur van het certificaat afloopt, moet het totale certificatieproces zijn afgerond, inclusief het updaten van de GMP+ Bedrijvendatabase (status en gegevens van certificaat) via de Certificatie Instelling.
Indien een hercertificatie audit/inspectie niet voor het verstrijken van de geldigheidsduur van het certificaat wordt uitgevoerd, moet een initiële certificatieaudit/inspectie worden uitgevoerd. Het GMP+ gecertificeerde bedrijf is in de tussenliggende periode niet GMP+ gecertificeerd.
Als aan de specifieke voorwaarden zoals beschreven in Appendix 5 “Niet op de locatie van het GMP+ gecertificeerde bedrijf” en/of Appendix 6 “Audits op afstand” wordt voldaan, kan de hercertificatieaudit dienovereenkomstig worden uitgevoerd.
5.2.1.7. Uitbreidingsaudit
Indien een GMP+ gecertificeerd bedrijf het bereik van zijn reeds verleende certificatie wil uitbreiden met een extra scope(s) en de uitbreiding niet kan wachten tot de volgende audit, moet de uitbreiding via de Certificatie Instelling worden beoordeeld.
Een Uitbreidings Audit (fase 1 en fase 2) moet alleen gericht zijn op activiteiten waarvoor de uitbreiding van toepassing is.
Als gevolg van een positieve beoordeling van de uitbreiding moet de Certificatie Instelling de extra scope(s) toevoegen aan:
- het GMP+ certificaat
- GMP+ Bedrijvendatabase
- GMP+ certificatieovereenkomst met het GMP+ gecertificeerde bedrijf.
5.2.2. Speciale audits
De volgende speciale audits kunnen van toepassing zijn, de beoordeling moet gebeuren volgens Appendix 1 of de GMP+ checklist Binnen- en kustvaarttransport van diervoeder.
5.2.2.1. Verscherpte controle Audit
Indien één of meer major non-conformities door de Certificatie Instelling worden geconstateerd, kan het GMP+ gecertificeerde bedrijf onder verscherpte controle worden gesteld voor één audit:
- De kosten van deze audit zijn voor rekening van het GMP+ gecertificeerde bedrijf.
- Deze audit vormt een aanvulling op de normale auditcyclus.
- De verscherpte tussentijdse audit vindt plaats binnen een periode van drie maanden.
- De beoordeling zal gebaseerd zijn op, maar niet beperkt tot de vastgestelde major non-conformity.
- Een major non-conformity kan ook administratief worden afgehandeld op basis van conformiteitsmaatregelen die door het GMP+ gecertificeerde bedrijf zijn geformuleerd.
Indien één of meer critical non-conformities door de Certificatie Instelling worden geconstateerd, moet het GMP+ gecertificeerde bedrijf in ieder geval onder verscherpte controle worden gesteld:
- De kosten van deze audits zijn voor rekening van het GMP+ gecertificeerde bedrijf.
- Deze audits vormen een aanvulling op de normale auditcyclus.
- De verscherpte tussentijdse audits worden maandelijks uitgevoerd, met een minimum van drie maanden en een maximum van zes maanden.
- De beoordeling zal gebaseerd zijn op, maar niet beperkt tot de vastgestelde critical non-conformity.
- Er moet één verscherpte tussentijdse audit op locatie worden uitgevoerd. Het is aan de Certificatie Instelling om te beslissen of er nog meer verscherpte tussentijdse audits nodig zijn. Deze beslissing moet gemotiveerd en gedocumenteerd worden.
5.2.2.2. Herhalingsaudit (RPA) en herhalingsinspectie (RI)
Een herhalingsaudit/inspectie zal worden uitgevoerd onder de verantwoordelijkheid van de Certificatie Instelling. De reden voor een herhalingsaudit/inspectie kan een EWS-melding zijn, klachten of incidenten, of andere speciale omstandigheden.
De herhalingsaudit/inspectie is in principe gericht op deze reden(en), maar kan ook gericht zijn op alle voorwaarden van het GMP+ Feed Certification scheme.
- GMP+ International kan de Certificatie Instelling vragen om in principe op korte termijn een herhalingsaudit/inspectie uit te voeren in aanwezigheid van een GMP+ International auditor en/of een technisch deskundige.
- De herhalingsaudit/inspectie moet worden uitgevoerd door een GMP+ auditor/inspecteur. De betrokken Certificatie Instelling moet de keuze van de GMP+ auditor/inspecteur motiveren en haar beslissing documenteren.
- De deadline wordt per geval beoordeeld, maar uiteindelijk bepaald door GMP+ International. De audit/inspectie wordt op locatie uitgevoerd. Daarnaast kunnen administratieve controles en een monstername worden uitgevoerd.
- De benodigde afspraken en communicatie over de herhalingsaudit/inspectie worden door de Certificatie Instelling in overleg met GMP+ International met het GMP+ gecertificeerde bedrijf gemaakt.
- De kosten van de herhalingsaudit/inspectie komen in principe voor rekening van GMP+ International. Indien echter blijkt dat één of meer Critical of Major non-conformities worden geconstateerd, worden de kosten doorberekend aan het GMP+ gecertificeerde bedrijf.
5.2.3. Buitengewone gebeurtenissen
Indien de Certificatie Instelling en/of Critical Location geconfronteerd wordt met een buitengewone gebeurtenis, moet GMP+ International deze status bevestigen. Ook wanneer de buitengewone gebeurtenis specifiek is voor een bedrijf moet de Certificatie Instelling contact opnemen met GMP+ International om deze status te bevestigen. Na bevestiging door GMP+ International is de Certificatie Instelling verplicht onderstaande richtlijnen te volgen op basis van het IAF-informatiedocument voor het beheer van buitengewone gebeurtenissen of omstandigheden die invloed hebben op de Certificatie Instellingen en GMP+ gecertificeerde bedrijven en die als volgt zijn beschreven:
- Het GMP+ gecertificeerde bedrijf of de bedrijfslocatie bestaat niet omdat deze is vernietigd door terroristische acties of oorlogshandelingen of is overgenomen door militairen of rebellen en/of pandemische overstromingen, aardbevingen of andere door de mens veroorzaakte en natuurrampen. De Certificatie Instellingen, critical/non- critical location wordt door de directie van het GMP+ gecertificeerde bedrijf of bedrijfslocatie geïnformeerd of ontvangt de informatie van een andere bron(nen). De Certificatie Instellingen, critical/non-critical location is verplicht te zoeken naar een bevestiging van het feit door middel van een betrouwbare bron. Na bevestiging trekt de Certificatie Instelling het GMP+ certificaat in en wordt GMP+ International direct schriftelijk op de hoogte gesteld, inclusief alle relevante gegevens.
- Het GMP+ gecertificeerde bedrijf of bedrijfslocatie is door het hoofdkantoor gesloten, omdat de regio niet veilig is. De directie van het bedrijf van het hoofdkantoor informeert de Certificatie Instelling, critical/non-critical location. De Certificatie Instelling trekt het GMP+ certificaat in en GMP+ International wordt direct schriftelijk geïnformeerd, inclusief alle relevante gegevens.
Het GMP+ gecertificeerde bedrijf of de bedrijfslocatie kan niet worden geauditeerd omdat GMP+ International bevestigd de buitengewone gebeurtenis; de Certificatie Instellingen, critical/non-critical location moeten zich houden aan een van de twee opties:
- Indien niet aan de auditfrequentie kan worden voldaan en in de veronderstelling dat voldoende bewijs is verzameld om het vertrouwen te geven dat het gecertificeerde managementsysteem van het GMP+ gecertificeerde bedrijf effectief is, kan worden overwogen de tussentijdse - of hercertificatieaudit voor een periode van maximaal drie maanden uit te stellen. Anders moet het GMP+ certificaat door de Certificatie Instelling worden geschorst. Tijdens de periode van schorsing moet de tussentijdse- of hercertificatieaudit worden uitgevoerd, anders moet het certificaat door de Certificatie Instelling worden ingetrokken.
- De audit Full remote of Guided remote audit uit te voeren op basis van de voorwaarden en vereisten van Appendix 6 van dit document.
- Indien wordt voldaan aan de specifieke voorwaarden zoals beschreven in Appendix 6 “Remote audits”, kunnen de audits dienovereenkomstig worden uitgevoerd.
5.2.4. Identificeren en registreren van audit- en inspectiebevindingen
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.4.5 en 9.4.6 |
| ISO/IEC 17020:2012 | Artikel 7.4 (alleen van toepassing voor de scope Binnen- en kustvaarttransport van diervoeder) |
Indien de aanvragende organisatie/GMP+ Gecertificeerd Bedrijf niet voldoet aan de voorwaarden van het GMP+ Feed Certification scheme, zijn de maatregelen en sancties zoals vermeld in Appendix 1 van toepassing.
Indien een non-conformity wordt geconstateerd in één van de FSA-scopes, in combinatie met een gelijkwaardig schema zoals genoemd in hoofdstuk 3 van TS1.2 Inkoop of met FRA, dan geldt dit voor zowel de FSA- als de FRA-scopes.
Multi-Site certificering:
Indien op het hoofdkantoor non-conformities worden geconstateerd, gelden deze non-conformities voor de gehele GMP+ Multi-site organisatie. Indien non-conformities worden geconstateerd op het niveau van een locatie, kan dit van invloed zijn op de locatie en/of het hoofdkantoor. Dit moet worden beoordeeld via de Certificatie Instelling.
Auditbevindingen van de afzonderlijke multi-sites moeten als indicatief voor het gehele systeem worden beschouwd en correctie moet dienovereenkomstig worden geïmplementeerd.
5.2.5. Afsluitend gesprek
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.4.7 |
Daarnaast niet van toepassing op de scope Binnen- en kustvaarttransport van diervoeder.
5.2.6. Auditrapportage/checklijst
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.4.8 |
| ISO/IEC 17020:2012 | Artikel 7.4 (alleen van toepassing voor de scope Binnen- en kustvaarttransport van diervoeder) |
Voor alle soorten audits/inspecties vindt de rapportage plaats volgens de modelrapportages in Appendix 3.
Binnen maximaal acht weken na de uitvoering van de audit/inspectie stuurt de Certificatie Instelling de GMP+ auditrapportage / checklijst naar de aanvragende organisatie/GMP+ gecertificeerd bedrijf.
De Certificatie Instelling moet een schriftelijke GMP+ auditrapportage verstrekken voor elke multi-site locatie die geaudit wordt. Het is ook mogelijk deze te integreren in de GMP+ auditrapportage van het hoofdkantoor. Indien dit het geval is moet in de GMP+ auditrapportage van het hoofdkantoor een overzicht worden opgenomen waaruit blijkt wanneer alle locaties / bedrijven zijn geaudit. In beide gevallen moet voor elke multi-site locatie een conforme of een niet-conforme GMP+ checklijst worden geüpload in de GMP+ Bedrijvendatabase. Bewijs voor conforme voorwaarden kan ook worden toegevoegd aan het GMP+ auditrapport/checklijst van het hoofdkantoor.
Indien GMP+ International de GMP+ auditrapportage / de checklijst opvraagt, stelt de Certificatie Instelling deze direct beschikbaar. In geval van een herhalingsaudit/inspectie moet GMP+ International binnen 5 werkdagen de GMP+ auditrapportage / de checklijst ontvangen.
Voor alle soorten audits/inspecties (inclusief documentatiebeoordeling) moet de volgende informatie in de GMP+ Bedrijvendatabase worden ingevoerd en binnen maximaal acht weken na uitvoering van de audit op locatie met GMP+ International worden gedeeld:
- Auditbevindingen/checklijst;
- Non-conformities (indien van toepassing);
- Eindbeoordeling van de aanvragende organisatie/GMP+ gecertificeerd bedrijf.
5.2.7. Review
De Certificatie Instelling moet beschikken over een proces om alle GMP+ audit/inspectie rapportages/checklijsten effectief te kunnen reviewen, inclusief:
- de door het auditteam verstrekte informatie voldoende is met betrekking tot de certificatievoorwaarden en de scope voor certificatie;
- deze voor elk type non-conformities de correctie en de corrigerende maatregelen heeft gereviewd, geaccepteerd en beoordeeld;
- de beoordeling van de aanvragende organisatie/GMP+ gecertificeerd bedrijf heeft plaatsgevonden in overeenstemming met de van toepassing zijnde scope(s) op basis van de algemene criteria zoals gespecificeerd in Appendix 1 en de aanvullende beoordelingscriteria in de checklist.
De conclusie en de reviewdatum door de technical reviewer moeten worden gedocumenteerd.
De technical reviewer moet de review onafhankelijk uitvoeren, wat betekent dat de technical reviewer geen deel had kunnen uitmaken van het GMP+ auditteam, ook niet als waarnemer.
5.2.8. Certificatiebeslissing
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.5 |
Daarnaast moet worden voldaan aan de beoordelingscriteria van Appendix 1 van dit document en/of de criteria van de checklist Binnen- en kustvaarttransport van diervoeder
5.2.9. Certificaat en Tijdelijke acceptatie
5.2.9.1. Certificaten
Een certificaat met een maximale geldigheidsduur van drie jaar kan worden afgegeven via de Certificatie Instelling, berekend vanaf de datum van een positieve certificatiebeslissing.De maximale geldigheidsduur voor de scope Binnen- en kustvaarttransport van diervoeder is 2 jaar, gerekend vanaf de datum van een positieve certificeringsbeslissing.
De duur van het GMP+ certificaat mag de geldigheidsduur van de certificatieovereenkomst niet overschrijden.
Binnen acht weken na de uitvoering van de audit/inspectie wordt het certificaat via de Certificatie Instelling naar de aanvragende organisatie/GMP+ gecertificeerde bedrijf gestuurd.
Voor een multi-site locatie moet duidelijk zijn waar de multi-site locatie gecertificeerd voor is volgens F0.3 Scopes voor certificatie. Het hoofdkantoor moet gecertificeerd zijn voor de scopes die alle activiteiten van de multi-site locaties omvatten.
Voor het afgeven van een certificaat geldt het volgende:
- De gecertificeerde multi-site locatie kan worden weergegeven in een Appendix die gekoppeld is aan het certificaat van de hoofdlocatie.
- Of er kan een individueel certificaat worden afgegeven per gecertificeerde multi-site locatie, met vermelding van het volgende:
- De activiteiten die worden uitgevoerd voor die specifieke locatie/rechtspersoon die onder deze certificering vallen, en
- Er moet traceerbaarheid zijn met het hoofdcertificaat, bijvoorbeeld een code;
Nuttige tip
Indien het GMP+ hoofdkantoor gecertificeerd is voor de scopes productie van mengvoeder en handel in diervoeder en de multi-site locaties een transport scope hebben, dan moet het GMP+ hoofdkantoor ook voor deze scope gecertificeerd zijn, omdat het beheren en controleren van het feed safety management system van de multi-site constructie centraal wordt beheerd door het GMP+ hoofdkantoor.
5.2.9.2. Tijdelijke acceptatie
Een tijdelijke acceptatie met een maximale geldigheidsduur van vier maanden kan via de Certificatie Instelling worden afgegeven. De duur van de tijdelijke acceptatie mag de geldigheidsduur van de certificatieovereenkomst niet overschrijden.
Indien echter tijdens de initiële certificatieaudit (fase 2) de aanvragende organisatie niet blijkt te voldoen aan de GMP+ voorwaarden voor de van toepassing zijnde scope(s) op basis van de algemene criteria zoals gespecificeerd in Appendix 1, moet de tijdelijke acceptatie worden ingetrokken.
Voor een multi-site locatie geldt het volgende:
- Per multi-site locatie wordt een tijdelijke acceptatie afgegeven of vermeld in een Appendix die gekoppeld is aan een tijdelijke acceptatie van de hoofdlocatie.
- Het moet duidelijk zijn waar de multi-site locatie voor geaccepteerd is volgens F0.3 Scopes voor certificatie.
5.2.9.3. Certificaat en Tijdelijke acceptatietemplates
De Certificatie Instelling moet de volgende tekst op het certificaat of de tijdelijke acceptatie zetten:
- Tekst voor certificaat Feed Safety Assurance
| Naam van de Certificatie Instelling: GMP+ International registratienummer van de Certificatie Instelling: Certificaat GMP+ FSA logo Naam, adres, locatie van het GMP+ gecertificeerde bedrijf (Adres waar GMP+-activiteiten plaatsvinden) Naam en EU-nummer van het vaartuig, indien van toepassing GMP+ International registratienummer van het GMP+ gecertificeerde bedrijf VASTE SECTIE = naam CB= verklaart dat er een gerechtvaardigd vertrouwen bestaat dat de GMP+ scope(s) = zoals vermeld in F0.3 Scope voor certificatie= bij het GMP+-gecertificeerde bedrijf = naam van het GMP+ gecertificeerde bedrijf = voldoen aan de geldende eisen en voorwaarden van de GMP+ Feed Safety Assurance Module 2020. " Het voedermanagementsysteem van de hele multi-site constructie is gecertificeerd en de geldigheid van dit certificaat is afhankelijk van de geldigheid van het certificaat van de hoofdlocatie" 1. VRIJE SECTIE Zie F0.3 Scope voor certificatie - Optional specification Statutaire zetel van de Certificatie Instelling Certificaatnummer Begin- en einddatum van het certificaat |
1Alleen in het geval van een individueel multi-site certificaat moeten deze zinnen in het certificaat worden opgenomen.
- Tekst voor tijdelijke acceptatie
| Naam van de Certificatie Instelling: GMP+ International registratienummer van de Certificatie Instelling: Tijdelijke acceptatie Naam, adres, locatie van het tijdelijk geaccepteerde bedrijf (Adres waar GMP+ activiteiten plaatsvinden) Naam en EU-nummer van het vaartuig, indien van toepassing GMP+ International registratienummer van het tijdelijk geaccepteerde bedrijf VASTE SECTIE = naam CB= verklaart dat er een gerechtvaardigd vertrouwen bestaat dat de GMP+ scope(s) = zoals vermeld in F0.3 Scope voor certificatie= bij het GMP+ tijdelijk geaccepteerde bedrijf = naam GMP+ tijdelijk geaccepteerd bedrijf = voldoen aan de criteria van een fase 1-beoordeling van de van toepassing zijnde voorwaarden en condities van de GMP+ Feed Safety Assurance Module 2020. ” Het voedermanagementsysteem van de hele multi-site constructie is tijdelijk geaccepteerd en de geldigheid van deze tijdelijke acceptatie is afhankelijk van de geldigheid van de tijdelijke acceptatie van het hoofdkantoor"1 VRIJE SECTIE Zie F 0.3 Scope voor certificering - Optional Specification Statutaire zetel van de Certificatie Instelling Tijdelijk acceptatienummer Begin- en einddatum van de tijdelijke acceptatie |
1Alleen in het geval van een individueel multi-site certificaat moeten deze zinnen in het certificaat worden opgenomen.
- Tekst voor een certificaat voor de scope Geregistreerd laboratorium:
| Naam van de Certificatie Instelling: GMP+ International registratienummer van de Certificatie Instelling Certificaat GMP+ FSA logo TS 4.2 Geregistreerd laboratorium Naam, locatie van het GMP+ gecertificeerde bedrijf Internationaal registratienummer van het GMP+ gecertificeerde bedrijf
De Certificatie Instelling =naam van de Certificatie Instelling= verklaart dat het GMP+ Gecertificeerde Bedrijf =naam GMP+ Gecertificeerde Bedrijf = is geauditeerd in overeenstemming met de van toepassing zijnde voorwaarden van de TS 4.2 Geregistreerd laboratorium en GMP+ Feed Safety Assurance Module 2020.
De Certificatie Instelling =naam Certificatie Instelling = verklaart op basis van een desk study dat voor de volgende analyses wordt voldaan aan de prestatiecriteria zoals genoemd in de TS 4.2 Geregistreerd laboratorium:
Geregistreerd kantoor van de Certificatie Instelling Certificaatnummer Begin- en einddatum van het certificaat | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Aanvullend is het volgende van toepassing voor alle certificaattemplates en tijdelijke acceptatie:
- De gegevens van het GMP+ gecertificeerde bedrijf/het tijdelijk geaccepteerde bedrijf moeten exact gelijk zijn aan de gegevens die zijn geregistreerd in de wettelijke bedrijfsregistratie.
(bijvoorbeeld Kamer van Koophandel/registratie bij bevoegde instantie, belasting/btw-nummer)
- Het is verplicht om het GMP+ FSA-logo op het certificaat te vermelden.
- Het is niet toegestaan het GMP+ FSA logo te vermelden op een tijdelijke acceptatie. Daarnaast mag het document geen "certificaat" worden genoemd, maar moet het worden aangeduid als een "tijdelijke acceptatie".
- Het is niet toegestaan de logo's van Critical Location, non-Critical Location te vermelden op het GMP+ certificaat en tijdelijke acceptatie anders dan de GMP+ geaccepteerde Certificatie Instelling.
- De startdatum van het certificaat/tijdelijke acceptatie is een datum die in ieder geval gelijk is aan of na de datum van de positieve certificering/tijdelijke acceptatiebeslissing.
- In geval van uitbreiding van scopes kan de einddatum van het geldige GMP+ certificaat niet worden verlengd. De Certificatie Instelling kan het GMP+ gecertificeerde bedrijf ook een nieuw GMP+ certificaat toekennen voor de aanvullende scope.
- Het is niet toegestaan om op het certificaat of de tijdelijke acceptatie op welke wijze dan ook merknamen te specificeren.
- (Contractuele) voorwaarden/vereisten zijn niet toegestaan op het GMP+ certificaat/tijdelijke acceptatie.
5.3. Schorsing of Intrekking van een certificaat en Tijdelijke acceptatie
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.6.5.1 |
Indien wordt vastgesteld dat een GMP+ gecertificeerd bedrijf / tijdelijk geaccepteerd bedrijf niet meer aan de voorwaarden voldoet, moeten er via de Certificatie Instelling direct sancties worden opgelegd conform Appendix 1.
De auditor moet critical non-conformities zoals gespecificeerd in Appendix 1 onmiddellijk melden aan de verantwoordelijke GMP+ coördinator.
In afwijking hiervan geldt voor de scope Binnen- en kustvaarttransport van diervoeder het volgende: Indien een “Niet Conform” met beschrijving wordt geconstateerd, moet het GMP+ certificaat worden ingetrokken. Een GMP+ certificaat kan alleen worden afgegeven als de “Niet Conform” met beschrijving is opgelost.
De verantwoordelijke GMP+ coördinator moet GMP+ International binnen twee werkdagen op de hoogte te stellen van het niet voldoen aan de voorwaarden door middel van het formulier Audit Finding Notification Critical Non-conformity, in het geval van:
- Een Critical non-conformity,
- Schorsing van het GMP+ certificaat,
- Intrekking van het GMP+ certificaat.
De GMP+ Bedrijvendatabase moet via de Certificatie Instelling worden aangepast naar de status: "geschorst of ingetrokken" met de reden "voldoet niet aan de voorwaarden" binnen twee werkdagen. Wanneer de Certificatie Instelling een critical non-conformity heeft vastgesteld, is het niet toegestaan het GMP+ certificaat in te trekken met als reden van intrekking " beëindiging van de overeenkomst". Na schorsing of intrekking van het certificaat kan het bedrijf niet meer deelnemen aan het GMP+ Feed Certification scheme onder een Poortwachtersprotocol.
GMP+ International is gerechtigd de geschorste / ingetrokken certificaten te publiceren.
5.4. Overstap naar een andere Certificatie Instelling
| Relevante voorwaarden zijn van toepassing | |
| ISO/IEC 17021-1:2015 | Artikel 9.5.3.3 |
Tijdens de geldigheidsduur van een GMP+ certificaat heeft een GMP+ gecertificeerd bedrijf het recht om over te stappen naar een andere Certificatie Instelling. Voor een dergelijke overstap gelden de volgende voorwaarden:
5.4.1. Pre-transfer review
De vertrekkende Certificatie Instelling is verplicht om alle relevante informatie/gegevens ter beschikking te stellen aan de accepterende Certificatie Instelling/Critical Location.
De accepterende Certificatie Instelling moet beschikken over een proces voor het verkrijgen van voldoende informatie om een besluit over certificatie te kunnen nemen en het overstappende GMP+ gecertificeerde bedrijf van het proces op de hoogte te stellen. Deze informatie moet minimaal afspraken bevatten met betrekking tot de certificatiecyclus.
De accepterende Certificatie Instelling stelt de competentiecriteria vast voor het personeel dat betrokken is bij pre-transfer review. De review kan door één of meer personen worden uitgevoerd. De persoon of de groep die het pre-transfer review uitvoert, moet over dezelfde competentie beschikken als die welke vereist is voor een auditteam dat geschikt is voor de gereviewde certificatiescope.
De accepterende Certificatie Instelling/Critical location moet een review uitvoeren van de certificering van het GMP+ gecertificeerde bedrijf. Deze review moet de volgende aspecten omvatten en de bevindingen ervan moeten worden gedocumenteerd:
- bevestiging dat de certificatie van het GMP+ gecertificeerde bedrijf binnen de geaccepteerde scope van de vertrekkende en accepterende Certificatie Instelling valt;
- de redenen voor het aanvragen van een overstap;
- dat de locatie(s) die de certificering wil overdragen in het bezit is (zijn) van een geldige certificatie;
- de initiële certificering of de meest recente rapportages van de her-certificatieaudit, en de meest recente tussentijdse rapportage; de status van alle openstaande non-conformities die daaruit kunnen voortvloeien en alle andere beschikbare, relevante documentatie met betrekking tot het certificatieproces;
- voor de scope Binnen- en kustvaarttransport van diervoeder een evaluatie van de laatste checklist om vast te stellen of een “Niet Conform” met beschrijving is waargenomen. Deze evaluatie kan andere relevante documentatie bevatten met betrekking tot het (her)certificatieproces, zoals aantekeningen, enz.
- indien één van de openstaande non-conformities de classificatie Critical heeft, is overstappen niet toegestaan;
- ontvangen klachten en genomen maatregelen;
- een eventuele lopende betrokkenheid van het overstappende GMP+ gecertificeerde bedrijf bij toezichthoudende instanties die relevant zijn voor de certificatiescope met betrekking tot de wettelijke naleving;
- bevestiging dat het GMP+ gecertificeerde bedrijf geen onvervulde contractuele verplichtingen heeft met de vertrekkende Certificatie Instelling.
5.4.2. Certificatieproces tijdens de overstap
Na een succesvolle pre-transfer review zijn de volgende voorwaarden van toepassing:
- De accepterende Certificatie Instelling, Critical/Non-Critical Location moet een GMP+ certificatieovereenkomst sluiten met de aanvragende organisatie (zie artikel 5.1.3.) alvorens het bedrijfsverzoek "Wijziging Certificatie Instelling" in te dienen bij GMP+ International Er moet een nieuwe certificatiecyclus worden gestart. Er moet een initiële certificatieaudit worden uitgevoerd.
- Openstaande non-conformities afgegeven door de vertrekkende Certificatie Instelling moeten vóór de overstap worden gesloten, anders moeten de non-conformities tijdens de initiële certificatieaudit door de accepterende Certificatie Instelling/Critical location worden gesloten. Voor de scope Binnen- en kustvaarttransport van diervoeder moet een open “Niet Conform” met beschrijving die tijdens de laatste inspectie is vastgesteld door de accepterende Certificatie Instelling/Critical Location tijdens de initiële inspectie worden gesloten.
- Er moet een nieuw certificaat worden afgegeven binnen 5 maanden na de datum van overdracht. Het is niet toegestaan een GMP+ certificaat van de vertrekkende Certificatie Instelling over te dragen aan de accepterende Certificatie Instelling. Een Certificatie Instelling mag geen overdracht accepteren van een bedrijf waarvan het GMP+ certificaat is geschorst of ingetrokken. Met uitzondering van ingetrokken op "annulering van de overeenkomst".
5.4.3. Samenwerking tussen de vertrekkende en de accepterende Certificatie Instellingen
| Relevante voorwaarden zijn van toepassing | |
| IAF Verplicht document voor de overdracht van geaccrediteerde certificering van beheersystemen – AF MD 2:2017 | Artikel 2.4 |
6. Uitsluiting van GMP+ International aansprakelijkheid
GMP+ International heeft geen enkele aansprakelijkheid met betrekking tot de beoordeling van aanvragende organisaties/GMP+ gecertificeerde bedrijven via de Certificatie Instellingen. De betreffende Certificatie Instellingen zullen GMP+ International hiervoor vrijwaren.
7. Tarieven
De Certificatie Instelling hanteert haar eigen tarief. Namens GMP+ International wordt via de Certificatie Instelling het betreffende tarief zoals opgenomen in de GMP+ CR4.0 Tarieven in rekening gebracht.
8. Geschillen tussen Certificatie Instellingen en GMP+ gecertificeerde bedrijven
Geschillen tussen de Certificatie Instellingen en de aanvragende organisatie/GMP+ gecertificeerde bedrijven met betrekking tot de beoordeling zullen in eerste instantie worden behandeld in overeenstemming met de geschillenregeling van de Certificatie Instelling. Indien dit niet tot een oplossing leidt, kan het geschil worden behandeld volgens de F0.5 Geschillenprocedure.
Appendix 1: Beoordelingscriteria en sancties voor audits GMP+ FSA
Non-conformities moeten worden geclassificeerd op basis van:
- De algemene beoordelingscriteria zoals vermeld in deze Appendix
- De specifieke beoordelingscriteria zoals weergegeven in de checklijsten.
De gespecificeerde sancties moeten minimaal worden opgelegd. Via de Certificatie Instelling is het toegestaan zwaardere sancties op te leggen. Als in deze tabel het certificaat wordt vermeld, geldt dit ook voor de tijdelijke acceptatie.
| Classificatie: Minor non-conformity | ||||
| Omschrijving | Gevolgen | Periode om af te sluiten | ||
| | ICA/RCA | SA | ||
| GMP+ gecertificeerde bedrijven:
| < 10 non-conformities | Certificaat kan worden afgegeven | Certificering kan worden voortgezet | tijdens volgende audit ter plaatse |
| ≥ 10 non-conformities | Certificaat kan niet worden afgegeven | Certificering kan worden voortgezet | binnen 6 weken | |
| Classificatie: Major non-conformity | |||
| Omschrijving | Gevolgen | Periode om af te sluiten | |
| ICA/RCA | SA | ||
| GMP+ gecertificeerde bedrijven:
| Certificaat kan niet worden afgegeven | De certificering kan worden voortgezet, maar er kan een verscherpte controle worden uitgevoerd (zie art. 5.2.2.1). | binnen 6 weken |
| Classificatie: Critical nonconformity | |||
| Omschrijving | Gevolgen | Periode om af te sluiten | |
| ICA/RCA | SA | ||
| GMP+ gecertificeerde bedrijven:
| Certificaat kan niet worden afgegeven | *Niveau 1. De certificering kan worden voortgezet, maar er moeten verscherpte controle audits worden uitgevoerd (zie art. 5.2.2.1). | Binnen 2 weken |
| *Niveau 2. Het certificaat moet worden geschorst: maximaal drie maanden | |||
| Opheffen van *niveau 2: Het certificaat kan alleen worden voortgezet als de Certificatie Instelling de critical nonconformity kan sluiten tijdens een verscherpte controle (zie art. 5.2.2.1). | |||
| *Niveau 3. Certificaat moet worden ingetrokken: minstens één jaar uitgesloten van deelname aan het GMP+ Feed certification scheme, evenals alle Poortwachtersopties. | |||
| GMP+ gecertificeerde bedrijven:
| Certificaat kan niet worden afgegeven | *Level 1. Certificaat moet worden geschorst: maximaal 3 maanden | |
| Opheffen van *niveau 1: Het certificaat kan alleen worden voortgezet als de Certificatie Instelling de critical nonconformity kan afsluiten tijdens een verscherpte controle (zie art. 5.2.2.1). | |||
| *Level 2. Certificaat moet worden ingetrokken: minstens één jaar uitgesloten van deelname aan het GMP+ Feed certification scheme, evenals alle Poortwachtersopties. | |||
* Sancties kunnen worden toegepast vanaf elk niveau.
Appendix 2: Frequentie en Audittijden
Frequentie
De audits moeten worden uitgevoerd volgens de volgende cyclus.
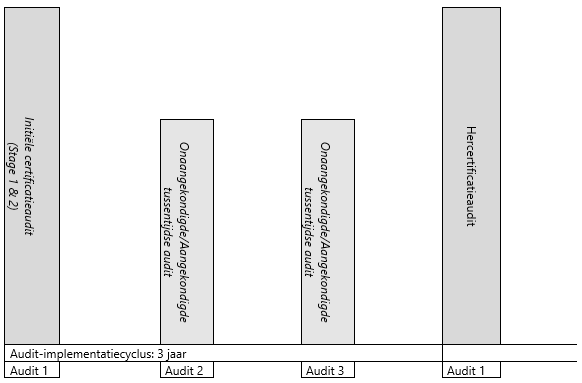
Dit is een kwalitatieve weergave van de auditcyclus voor de uitvoering van GMP+ audits.
De audittijden worden uitgedrukt in dagen, één dag is acht uur. Audittijden omvatten fase 1 & 2 voor de initiële certificatieaudit. De tabellen in deze Appendix geven de verplichte minimum audittijden inclusief voorbereiding en rapportage van de audit. De on-site audittijd moet minstens 70% bedragen van de minimaal verplichte audittijd voor alle soorten audits (uitgezonderd de gevallen van niet on-site uitgevoerde fase 1 audits). Indien correct gedocumenteerd en gerechtvaardigd kan een reductie van de minimaal verplichte audittijden worden afgegeven aan een minder complexe organisatie gemeten naar een eenvoudig productieproces, omvang van de organisatie, productvolume (inclusief een beperkt aantal producten), seizoensgebonden actief zijn, etc. Het GMP+ gecertificeerde bedrijf moet een aangepaste offerte/certificatieovereenkomst ontvangen. GMP+ International zal de onderbouwing controleren en beoordelen tijdens de jaarlijkse Certificatie Instelling audit. De audittijdreductie moet verwerkt worden in de GMP+ bedrijvendatabase.
De Certificatie Instelling kan geen reductie van de audittijd geven, indien:
- De minimaal verplichte audittijd met meer dan 30% wordt verminderd
- Tijdens de geldigheidsduur van het GMP+ certificaat al een reductie van de audittijd bestaat en er geen wijzigingen in de activiteiten hebben plaatsgevonden.
- Tijdens de laatste drie audits bij het GMP+ gecertificeerde bedrijf één Critical non-conformity werd vastgesteld.
- Tijdens de laatste drie audits bij het GMP+ gecertificeerde bedrijf één Major non-conformity werd vastgesteld met een structureel karakter of de Major nonconformity die heeft geleid tot een gevaar voor de voederveiligheid.
- Tijdens de laatste drie audits bij het GMP+ gecertificeerde bedrijf 20 of meer Minor non-conformities zijn vastgesteld.
- Audittijd in mindering gebracht voor een gecombineerde audit.
- Tabel 2 van deze Appendix wordt toegepast.
Bovendien kan aan de audittijden van Appendix 4 van dit document geen reductie van de audittijd worden toegekend.
Via de Certificatie Instelling kan alleen reductie van de audittijd worden verleend bij de initiële certificatieaudit, indien de Certificatie Instelling kan aantonen dat zij het bedrijf heeft gecertificeerd voor een ander schema zoals genoemd in deze Appendix en/of een gelijkwaardig schema zoals genoemd in TS 1.2 Inkoop en correct gedocumenteerd en gerechtvaardigd. De reductie van de audittijd mag niet worden gebruikt voor het her-berekenen van de minimaal verplichte audittijden, tenzij tijdens de initiële certificatieaudit zoals hierboven vermeld.
Deze tijdelijke afwijking van de audittijd geldt zolang:
- er geen wijzigingen plaatsvinden in de activiteiten en organisatie van het GMP+ gecertificeerde bedrijf
- er geen wijzigingen worden aangebracht in deze Appendix met betrekking tot de audittijden.
- het GMP+ gecertificeerde bedrijf niet overgaat naar een andere Certificatie Instelling. Indien het GMP+ gecertificeerde bedrijf overgaat naar een nieuwe Certificatie Instelling, moet de niewe Certificatie Instelling beoordelen of er een reductie van de audittijd kan worden afgegeven.
In geval van herhalingsaudits en verscherpte controle , zoals gespecificeerd in artikel 5.2.2, geldt de audittijd die door de Certificatie Instelling of GMP+ International noodzakelijk wordt geacht. De audittijden kunnen oplopen indien EWS, klachten, ontheffingen, incidenten, etc. via de Certificatie Instelling onderzocht moeten worden.
De ranglijst moet als volgt worden toegepast:
- Productie van mengvoeder
- Productie van voormengsels
- Productie van toevoegingsmiddelen
- Productie van voedermiddelen
- Productie van huisdiervoeder
- Handel in diervoeder
- Op- en Overslag van diervoeder
- Transport van diervoeder
- Bevrachting
Voor de berekening van de minimaal verplichte (Initiële Certificatieaudit (ICA); (on)aangekondigde tussentijdse audit (USA/ASA) en hercertificatieaudit (RCA)) audittijd voor één locatie wordt de volgende formule gehanteerd:
Ts=TD+TH1 (indien van toepassing)+TFTE
Waarbij:
Ts: minimale audittijd;
TD: is de basis audittijd, in dagen;
TH1: is het aantal auditdagen voor aanvullende GMP+ scopes;
TFTE: is het aantal auditdagen per aantal medewerkers.
| Tabel 1 | |||||
| Minimale verplichtte audittijden1 : Ts=TD+TH1 (indien van toepassing)+TFTE | |||||
| | Basisaudittijd in dagen | Aantal auditdagen voor elke bijkomende GMP+ scope | Totaal aantal werknemers (FTE7 relevant voor personeel gerelateerd aan alle GMP+ activiteiten, uitgedrukt in auditdagen) | Aftrekbare GMP+audittijden in geval van een gecombineerde audit met een geldige versie van equivalente schema's/scopes zoals vermeld in GMP+ TS1.2 Inkoop | Aftrekbare audittijden in geval van een gecombineerde audit5 |
| GMP+ scopes | TD | TH1 | TFTE | | |
| Productie van mengvoeder2 + 3 + 6 | 1,75 | 0,1875 | 1 tot 19 = 0 >200 = 0,5 | Reductie van maximaal 75% van de minimaal verplichte audittijden. | Reductie van maximaal 50% van de minimaal verplichte audittijden. |
| Productie van voormengsels6 | 1,75 | 0,1875 | |||
| Productie van toevoegingsmiddelen6 | 1,75 | 0,1875 | |||
| Productie van voedermiddelen3 + 6 | 1,125 | 0,1875 | |||
| Handel in diervoeder3+ 8+ 9 | 1,00 | 0,1875 | |||
| Op- en Overslag van diervoeder8+ 9 | 1,00 | 0,1875 | |||
| Transport van diervoeder4 + 8+ 9 | 1,00 | 0,1875 | |||
| Bevrachting8+ 9 | 0,70 | N.A. | |||
| 1Van toepassing op alle soorten audits (speciale audits overeenkomstig artikel 5.2.2 zijn uitgesloten). 2 Zonder het gebruik van kritische toevoegingsmiddelen en/of diergeneesmiddelen kunnen de audittijden worden gereduceerd met een maximum van 0,25 dagen per locatie . 3 Van toepassing op huisdiervoeder. 4 Voor wegtransport is de bevrachting van het wegtransport inbegrepen. 5 ISO9001 en/of ISO22000 scope diervoeder in combinatie met ISO22002-6 en/of IFS levensmiddelen en/of BRC productie en/of FSSC 22000. 6 Wanneer een organisatie werknemers in ploegendienst inzet en de producten en/of processen vergelijkbaar zijn, wordt het FTE-aantal berekend op basis van werknemers in de hoofdploeg (inclusief seizoenarbeiders) plus kantoorpersoneel. 7 Aantal werknemers is inclusief deeltijdwerkers berekend als percentage van FTE. 8 Als een factuuradres van toepassing is, is de minimaal verplichte audittijd 0,125 dagen. 9 Als een postbus van toepassing is, is de minimaal verplichte audittijd 0,125 dagen. | |||||
| Tabel 2 | |||||||||||
| Aanvullende voorwaarden voor de berekening van de audittijd | |||||||||||
| Elke extra geauditeerde productielocatie1 | 1 dag alle type audits. | ||||||||||
| Elke extra geauditeerde productielocatie1 die mengvoeder produceert met gebruik van kritische toevoegingsmiddelen en/of kritische diergeneesmiddelen | 1,25 dag alle soorten audits. | ||||||||||
| Handel in diervoeder ≤ 2 TFTE2 | Reductie van maximaal 0,1875 dag per audittype. | ||||||||||
| Handel in diervoeder “fouragehandel” ≤5 producten | Reductie van maximaal 0,5 dag per audittype. | ||||||||||
| Handel aan veehouderijen | Reductie van maximaal 0,75 dag per audittype. | ||||||||||
| Op- en Overslag van diervoeder ≤ 5 TFTE2 | Reductie van maximaal 0,1875 dag per audittype. | ||||||||||
| Wegtransport van diervoeder, ≤ 2 TFTE2 | Reductie van maximaal 0,63 dag per audittype. | ||||||||||
| Wegtransport van diervoeder, 3 - 5 TFTE2 | Reductie van maximaal 0,40 dag per audittype. | ||||||||||
| Railtransport van diervoeder | Reductie van maximaal 0,30 dag per audittype. | ||||||||||
| Antibioticavrije productielocatie (altijd aanvullend) | 0,25 dag per type audit | ||||||||||
| Dioxinemonitoring in diervoeder voor leghennen (altijd aanvullend) | 0,125 dag per type audit | ||||||||||
| QM-Milch3 (altijd aanvullend) | 0,125 dag per typeaudit | ||||||||||
| 1 Voorwaarden voor een extra productielocatie : Een locatie die een wettelijke of contractuele band heeft met het GMP+ gecertificeerde hoofdkantoor van de organisatie en onderworpen is aan een gemeenschappelijk managementsysteem, dat is vastgelegd, vastgesteld en onderworpen aan voortdurend tussentijdse en interne audits door het hoofdkantoor. Dit betekent dat het hoofdkantoor het recht heeft te eisen dat de locaties corrigerende maatregelen implementeren wanneer dat nodig is op elke locatie. Daar waar van toepassing moet dit worden vastgelegd in een formele overeenkomst tussen het hoofdkantoor en de locaties. Voor elke extra FSA-scope moet 0,1875 worden toegevoegd. 2 Alleen van toepassing indien de onderneming voor één scope is gecertificeerd. Als het bedrijf voor meerdere scopes gecertificeerd is, is het totale aantal FTE dat betrokken is bij GMP+-activiteiten van toepassing. Zie voorbeeld in Helpful tip. 3 Daarnaast kan een afwijking van de minimaal verplichte audittijden, met inbegrip van de initiële certificeringsaudit (ICA), van toepassing zijn indien aan de volgende voorwaarden wordt voldaan:
Als al deze QM-Milch-voorwaarden op het hoofdkantoor kunnen worden beoordeeld, zijn de extra audittijden in de onderstaande tabel voor het hoofdkantoor van toepassing.
| |||||||||||
Nuttige tip
Voorbeeld: Een handelaar met 1 FTE en de aanvullende scope Op- en Overslag van diervoeder met 2 FTE's resulteert in 3 TFTE met betrekking tot GMP+ activiteiten. Als gevolg voldoet de handelaar niet aan de criteria Handel in diervoeder ≤ 2 TFTE.
| Tabel 3 | |||||
| GMP+ FSA module | Aantal analyses | Audit-/inspectie-frequentie | Minimale audit-/inspectietijden in dagen, audittijdreductie is niet toegestaan, tenzij een van de voetnoten van toepassing is |
| |
|
|
|
| Initiële of hercertificatie audit/inspectie | Aangekondigde/ onaangekondigde tussentijdse audit | Opmerking |
| Scope: Laboratoriumonderzoek |
|
|
|
|
1 + 2 + 3 |
| ISO/IEC17025 geaccrediteerd
| < 5 | 1x / jaar | 0,25 | 0,25 | |
| 5-15 | 1x / jaar | 0,38 | 0,38 | ||
| >15 | 1x / jaar | 0,50 | 0,50 | ||
| Gedeeltelijk ISO/IEC17025 geaccrediteerd | < 5 | 1x / jaar | 0,69 | 0,69 | |
| 5-15 | 1x / jaar | 1,00 | 1,00 | ||
| >15 | 1x / jaar | 1,19 | 1,19 | ||
| Niet ISO/IEC17025 geaccrediteerd |
|
|
|
| |
| Hoofdlocatie (incl. systeem) | < 5 | 1x / jaar | 1,00 + 1,00 | 0,81 + 0,81 | |
| 5-20 | 1x / jaar | 1,19 + 1,19 | 1,19 + 1,19 | ||
| >20 | 1x / jaar | 1,50 + 1,50 | 1,19 + 1,19 | ||
| Secundaire locatie (analyses) | < 5 | 1x / jaar | 0,63 | 0,69 | |
| 6-20 | 1x / jaar | 0,81 | 0,94 | ||
| >20 | 1x / jaar | 1,00 | 1,19 | ||
| Scope: Geregistreerd laboratorium |
|
|
|
|
|
| dat alle analyses uitbesteedt |
| 1x / jaar | 0,50 | 0,50 | 4 |
| dat analyses gedeeltelijk uitbesteedt |
| 1x / jaar | 1,006 | 1,006 | 4 +5 |
| zonder uitbesteding van enige analyse |
| 1x / jaar | 1,006 | 1,006 | 5 |
| Scope: Kust- en binnenvaarttransport van diervoeder |
| 1x / 2 jaar | 0,25 | n.v.t. |
|
| 1 Soorten laboratoria: - Als het laboratorium voor meer dan 50 analyses geaccrediteerd is volgens ISO/IEC17025 mag de minimale audittijd verhoogd worden met 0,094 dagen. - Als het laboratorium niet is geaccrediteerd volgens ISO 17025; zowel de materiaalspecialist als de auditor bezoeken het laboratorium voor systeembeoordeling. 2 Als een laboratorium is gecertificeerd voor zowel TS4.1 Laboratoriumonderzoek als ISO 9001; 2000 of ISO22000 dan mag een audittijdreductie van 35% worden toegepast op voorwaarde dat het laboratorium beschikt over het van toepassing zijnde ISO-certificaat of de van toepassing zijnde ISO-certificaten. De verkorte audittijden mogen alleen worden gebruikt als alle secundaire locaties werken volgens het kwaliteitssysteem van de hoofdlocatie. De systeemvoorwaarden en analyses worden beoordeeld op de hoofdlocatie. Op de secundaire locaties worden alleen de analyses beoordeeld. 3 De voorwaarden van de scope Laboratoriumonderzoek en de andere GMP+ scopes zijn dermate verschillend dat een gecombineerde audit voor de scope Laboratoriumonderzoek en één of meer van de andere GMP+ scopes geen audittijdreductie oplevert. 4 De audittijden betreffen de beoordeling van één analyse. Voor de beoordeling van elke uitbestede aanvullende analyse moet 0,5 uur worden opgeteld. 5 De audittijden betreffen de beoordeling van één analyse. Voor de beoordeling van elke uitvoerende extra analyse moet 2,0 uur worden toegevoegd. 6 De audittijden voor het auditen van TS4.2 Geregistreerde laboratoria kunnen tot 50% worden verminderd als de beoordeling wordt uitgevoerd in combinatie met de scope Laboratoriumonderzoek. De audittijden voor het auditen van TS4.2 Geregistreerde Laboratoria kunnen tot 50% worden verminderd als het bedrijf een accreditatie heeft volgens ISO/IEC17025. | |||||
| Extra audittijden in dagen voor het beoordelen van Poortwachtersdossiers | |||
| Aantal Poortwachter dossiers | Minimumaantal dossiers die per 3 jaar moeten worden beoordeeld | TS1.2: 4.3.4 Inkoop van voormalige levensmiddelen 4.3.6. Inkoop van voedermiddelen van minerale origine 4.3.7 Inkoop van bewerkte voedermiddelen | TS1.2: 4.3.2 Inkoop van onbewerkte granen, (olie)zaden en peulvruchten uit een verzamelketen 4.3.5 Inkoop van palmolie 4.3.8 Inkoop van diervoeder voor voederproeven 4.4.1 Inkoop van wegtransport 4.4.2 Inkoop van binnenvaarttransport 4.4.3 Inkoop van op= en overslag 4.5.2 Grondstof voor soap stock splitting |
| 1 tot 5 | alles | 0,125 per dossier | 0,063 per dossier |
| 6 tot 10 | 5 | 0,125 per dossier | 0,063 per dossier |
| 11 tot 15 | 6 | 0,125 per dossier | 0,063 per dossier |
| 16 tot 30 | 7 | 0,125 per dossier | 0,063 per dossier |
| 31 tot 50 | 8 | 0,125 per dossier | 0,063 per dossier |
| 51 tot 100 | 9 | 0,125 per dossier | 0,063 per dossier |
| > 100 | 10 | 0,125 per dossier | 0,063 per dossier |
Appendix 3: Rapportagemodel of audit rapportage / inspectiechecklijst *
Rapportagemodel A:
1 Algemene details
Details van de hoofdlocatie :
Naam van het GMP+ gecertificeerde bedrijf :
Adres :
Postcode en plaats :
Telefoon :
E-mail :
GMP+ registratienummer :
Wettelijk bedrijfsregistratienummer :
Contactpersoon :
Gesproken met:
| Naam | Functie |
| | |
| | |
De beoordeling wordt uitgevoerd in overeenstemming met het GMP+ Feed Certification scheme 2020.
Overzicht van alle bedrijfslocaties (incl. hoofdkantoor) en GMP+ scopes
| GMP+ registratie-nummer | Naam locatie | Adres, Postcode, Plaats, Land | Toepasselijke GMP+ scopes | Vervaldatum van het huidige certificaat of tijdelijke acceptatie: |
| | | | | |
| | | | | |
Lijst van locaties in het geval van multi-site certificering (indien van toepassing)
| GMP+ registratie-nummer locatie | Naam locatie | Adres Postcode, Plaats, Land | Toepasselijke GMP+ scopes | Auditdatum |
| | | | | |
Auditdetails:
□ Initiële certificatieaudit - op locatie
□ Initiële certificatieaudit - Volledig op afstand
□ Initiële certificatieaudit - Geleide audit op afstand
□ Aangekondigde tussentijdse audit – op locatie
□ Aangekondigde tussentijdse audit - Volledig op afstand
□ Aangekondigde tussentijdse audit - Geleide audit op afstand
□ Onaangekondigde tussentijdse audit - op locatie
□ Onaangekondigde tussentijdse audit - Volledig op afstand
□ Onaangekondigde tussentijdse audit - Geleide audit op afstand
□ Hercertificatieaudit – op locatie
□ Hercertificeringsaudit - Volledig op afstand
□ Hercertificatieaudit - Geleide audit op afstand
□ Uitbreidingsaudit – op locatie
□ Uitbreidingsaudit - Volledig op afstand
□ Uitbreidingsaudit - Geleide audit op afstand
□ Herhalingsaudit
□ Verscherpte controle
□ Documenten beoordeling (in geval van een tijdelijke acceptatie)
□ Audit/Inspectie*tijden (in dagen)
□ Combinatie-audit ja/nee toepasselijk kwaliteitsschema:
□ Anders;
Datum van de documenten beoordeling :
Audit datum :
Rapportage datum :
GMP+ gecertificeerde bedrijven vertegenwoordiger met inbegrip van naam en functie :
Documenten beoordeeld :
Certificatie Instelling :
(Lead) Auditor(s) :
Co-auditor 1 :
Co-auditor 2 :
Technisch deskundige(n) :
Gids :
Naam ________________________ Handtekening (Auditor) ________________________
2 Scope GMP+ Gecertificeerd Bedrijf/locaties
Specificeer het type GMP+ gecertificeerd bedrijf en haar activiteiten. Beschrijf de producten en hoeveelheden. Geef de aard en het aantal personeelsleden (vast, tijdelijk) per locatie aan. Beschrijf de organisatiestructuur. Maak ook meldingen van andere bedrijven op dezelfde locatie of onder dezelfde holding (met vergelijkbare namen of onverenigbare activiteiten). Geef een korte samenvatting van het hele proces en documentatie van het managementsysteem, bijvoorbeeld inkoop, productieproces, opslag, verkoop en transport van hoofd- en nevenproductstromen (met de nadruk op de relatie met de activiteiten waarop de aanvraag betrekking heeft). Geef ook aan of het GMP+ gecertificeerde bedrijf het Poortwachtersprincipe toepast en beschrijf de activiteiten.
3 Auditdoelstellingen
De auditdoelstellingen moeten beschrijven wat met de audit moet worden bereikt en moeten de volgende onderwerpen bevatten:
- Bepaling van de conformiteit van het feed safety management system van de klant, of delen daarvan, met de auditcriteria,
- Evaluatie van het vermogen van het Quality Management System om te verzekeren dat de organisatie van het GMP+ gecertificeerde bedrijf voldoet aan de geldende wettelijke, reglementaire en contractuele voorwaarden.
- Evaluatie van de effectiviteit van het Quality Management System om te verzekeren dat de organisatie van het GMP+ gecertificeerde bedrijf voortdurend aan de gestelde doelstellingen voldoet.
- Indien van toepassing, identificatie van gebieden voor mogelijke verbetering van het managementsysteem.
4 Afwijking van het auditplan/significante kwesties die van invloed zijn op het auditprogramma.
Reden voor de afwijking moet worden vermeld en significante kwesties die van invloed zijn op het auditprogramma.
5 Welke onderwerpen zijn beoordeeld en geconcludeerd
In het algemeen moet in het verslag duidelijk zijn wat er is beoordeeld en wat de conclusie van de auditor was.
Verificatie van de effectiviteit van de genomen corrigerende maatregelen met betrekking tot eerder geconstateerde nonconformities, indien van toepassing.
Per auditdoelstelling moet een conclusie worden gegeven.
6 Samenvatting van de beoordeling en een algemene conclusie
Begin met een standaardzin zoals "Het GMP+ gecertificeerde bedrijf is geaudit voor een tussentijdse audit van de GMP+ voorwaarden. Het GMP+ gecertificeerde bedrijf is beoordeeld op de voorwaarden van de toepasselijke GMP+ scopes".
Geef aan of de bij de vorige audit geconstateerde nonconformities zijn gesloten.
Maak een samenvatting per locatie en in het totaal.
Geef een korte samenvatting van de algemene indruk van het kwaliteitssysteem van het GMP+ gecertificeerde bedrijf.
Mogelijk postscriptum na een definitieve beoordeling door de technical reviewer: review van aanvullende documenten en follow-up.
| Aantal geconstateerde nonconformities van de audit | |||||||||
| Locatie | Tijdens vorige audit | Tijdens audit | Bij eindbeoordeling | ||||||
| | Aantal audit nonconformities | Aantal audit nonconformities | Aantal audit nonconformities | ||||||
| | Critical | Major | Minor | Critical | Major | Minor | Critical | Major | Minor |
| | | | | | | | | | |
Auditconclusie: het GMP+ gecertificeerde bedrijf voldoet/voldoet niet aan de voorwaarden van de GMP+ module.
Maatregelen en sancties: conformity audit, herhalingsaudit, verscherpte controle (inclusief tijdsduur), schorsing, intrekking.
7 Appendices
Gebruikte checklijsten, rapportageformulieren voor audit nonconformities.
Let op: geconstateerde nonconformities moeten ook in de Engelse/Duitse of Nederlandse taal worden geregistreerd.
Rapportagemodel B:
Auditrapportage / Inspectie Checklijst*
(Dit is een impressie van de Auditrapportage/Inspectie Checklijst*. Raadpleeg voor de laatste versie altijd de Auditrapportage/Inspectie Checklijst* die in de GMP+ Database/Auditapp is verwerkt)
| Certificatie Instelling | ||
| Certificatie Instelling | | |
| Bedrijfsgegevens | |||
| GMP+ registratienummer | | ||
| Bedrijfsnaam | | ||
| Bedrijfsrelatie | | ||
| Adres van het bedrijf | | ||
| Postadres | | ||
| Wettelijk bedrijfsregistratienummer. | | ||
| Telefoon 24 uur per dag, 7 dagen per week | | ||
| E-mailadres | | ||
| Gesproken met, naam en functie | | ||
| Poortwachtersdossiers | | Aantal poortwachtersbestanden - TS 1.2 4.3.3 Inkoop van toevoegingsmiddelen, levensmiddelen, farmaceutische producten, kruiden en specerijen 4.3.4 Inkoop van voormalige voedingsmiddelen 4.3.6 inkoop van voedermiddelen van minerale origine 4.5.1. Andere producten en diensten | |
| | | Aantal poortwachtersbestanden - TS 1.2 4.3.1 Inkoop van onbewerkte landbouwproducten van de teler voor gebruik in of als diervoeder 4.3.2 Inkoop van onbewerkte granen, (olie)zaden en peulvruchten uit een verzamelketen 4.3.5 Inkoop van palmolie 4.3.7. Inkoop van bewerkte voedermiddelen 4.3.8 Inkoop van diervoeder voor voederproef 4.4.1 Inkoop van wegtransport 4.4.2 Inkoop van binnenvaarttransport 4.4.3 Inkoop van op- en overslag 4.5.2 Grondstof voor soap stock splitting | |
| Aantal fte’s | | ||
| Naam van het schip | | ||
| Scheepseigenaar | | ||
| Scheepsregistratienummer/EU-nummer | | ||
| Scheepsgrootte in tonnage | | ||
| Totaal Kubieke inhoud | | ||
| Aantal ruimen | | ||
| Soort luikdeksel | | ||
| Vloersoort (staal, hout) | | ||
De beoordeling wordt uitgevoerd in overeenstemming met het GMP+ Feed Certification scheme 2020.
| Certificering | ||||
| Scope | Module | Gecertificeerd sinds | Begin datum | Eind datum |
| | | | | |
| Bedrijfsrelatie | ||
| Verbonden met | Bedrijfsrelatie | |
| | ||
| Audit/Inspectie*gegevens | ||
| Audit/Inspectie*datum | | |
| Rapportagedatum | | |
| Certificatie Instelling | | |
| Certificatie Instelling - GMP+ registratienummer | | |
| (Lead) Auditor/Inspecteur* | | |
| Gids | | |
| Co-auditor 1 | | |
| Co-auditor 2 | | |
| Reviewer | | |
| Observant | | |
| Technisch/Materie deskundige | | |
| Op afstand | Ja/Nee | Methode |
| Audit/Inspectie* type | | |
| Audit/Inspectie*tijden (in dagen) | | |
| Gecombineerde audit | | |
| Certificaat van het gecombineerde schema | Ja/Nee | Geldigheid |
| Scopes en modules van de audit | |
| | |
Auditdoelstellingen
| In de auditdoelstellingen moeten beschrijven wat er met de audit moet worden bereikt en moeten de volgende onderwerpen bevatten:
|
Afwijking van het auditplan/significante kwesties die van invloed zijn op het auditprogramma.
Reden voor de afwijking die moet worden vermeld en significante kwesties die van invloed zijn op het auditprogramma het auditprogramma.
Algemene informatie
GMP+ gecertificeerd bedrijf/locatie
| De gedefinieerde processen en documentatie van het managmentsysteem dat is ontwikkeld door het GMP+ gecertificeerde bedrijf / de aanvragende organisatie. |
| Auditvoorwaarden | ||||
| Art. Nr | Scope | Module | Auditvraag | Naleving |
Verificatie van de effectiviteit van de genomen corrigerende maatregelen met betrekking tot eerder vastgestelde nonconformities, indien van toepassing.
Andere beoordeelde onderwerpen
| Non-Conformities vorige Audit |
| Non-Conformities Huidige Audit |
Auditconclusie
| Per auditdoelstelling moet een conclusie worden gegeven. |
| |
| Eindbeoordeling |
| Goed gekeurd/Niet goedgekeurd |
| Datum, plaats | Handtekening Auditor, |
| | |
| Datum, plaats | Handtekening Reviewer, |
| | |
| Datum, plaats | Handtekening Klant |
| | |
| Bijlage bij het rapport NCR-formulier ja/nee | |
* Wanneer de terminologie inspecteur / inspectie / inspectiechecklist wordt gebruikt, verwijst dit naar de scope Binnen- en kustvaarttransport van diervoeder, zoals vastgelegd in CR 3.0.
Appendix 4A: Multi-site certificering
Multi-site certificering is mogelijk:
- Bij een GMP+ gecertificeerd bedrijf met een hoofdkantoor met 100% dochterondernemingen, of
- Bij een groep bedrijven die zich hebben verenigd als een kwaliteitsgemeenschap.
Een multi-site organisatie hoeft geen unieke rechtspersoon te zijn, maar alle multi-site locaties moeten een juridische of contractuele link hebben met het hoofdkantoor van de multi-site organisatie en onderworpen zijn aan een gemeenschappelijk managementsysteem, dat is uiteengezet, vastgesteld en onderworpen aan een voortdurende aangekondigde controle en interne audits door het hoofdkantoor. Dit betekent dat het hoofdkantoor het recht heeft om van de multi-site locaties te eisen dat zij corrigerende maatregelen nemen wanneer dit op een locatie vereist is. Waar van toepassing, moet dit worden vastgelegd in een formele overeenkomst tussen het hoofdkantoor en de multi-site locaties.
Multi-site certificering mag niet worden gebruikt als verschillende onafhankelijke bedrijven zich hebben verenigd in een brancheorganisatie, vakbond, federatie, vereniging, via een onafhankelijk adviesbureau of iets dergelijks.
Multi-site certificering is niet toegestaan voor de FSA scopes van:
- Productie van mengvoeder;
- Productie van voormengsels;
- Productie van voedermiddelen;
- Productie van toevoegingsmiddelen.
- Laboratoriumonderzoek;
- Geregistreerd laboratorium;
- Kust- en binnenvaarttransport van diervoeder.
Multi-site certificering is toegestaan voor alle FSA scopes van:
- Handel in diervoeder;
- Op- en Overslag van diervoeder;
- Transport van diervoeder;
- Bevrachting.
Nuttige tip
Als, bij voorbeeld, een groep bedrijven bestaat uit meerdere productielocaties en opslaglocaties, kunnen de productielocaties in deze groep niet onder multi-site worden gecertificeerd, maar voor opslaglocaties is dit wel mogelijk.
1. Algemene voorwaarden
- De multi-site organisatie valt onder hetzelfde kwaliteitssysteem dat door het hoofdkantoor wordt beheerd. Dit kwaliteitssysteem voldoet aan de relevante GMP+ scope(s) en er moet op alle muti-site locaties worden voldaan aan de relevante GMP+ voorwaarden (zie ook de gebruikerstip onder Certificering).
- Op de multi-site organisatie wordt er volgens dezelfde methoden en procedures gewerkt.
- Vanuit het hoofdkantoor kunnen corrigerende maatregelen worden opgelegd aan de multi-site locaties.
- Er moet een schriftelijke overeenkomst zijn tussen de multi-site locaties en het hoofdkantoor. Deze overeenkomst moet door alle deelnemende partijen worden ondertekend en de ondertekende overeenkomst moet aanwezig zijn op het hoofdkantoor en beschikbaar zijn voor de auditor. In de overeenkomst moet ten minste zijn opgenomen:
- een verplichting van de multi-site locatie aan het hoofdkantoor dat het zal voldoen aan de in het kwaliteitssysteem gestelde eisen.
- dat de door het hoofdkantoor opgelegde corrigerende maatregelen bindend zijn.
- dat het bovenstaande van toepassing is op alle diervoederactiviteiten ( dus ook die wie min of meer zelfstandig worden uitgevoerd).
- Alle multi-site locaties zijn opgenomen in het programma van interne audits. De interne audit moet één keer per jaar op alle multi-site locaties worden uitgevoerd.
- Het hoofdkantoor moet aantonen dat het in staat is om van elke multi-site locatie gegevens te verzamelen, deze te analyseren en waar nodig wijzigingen te implementeren met betrekking tot:
- Systeemdocumenten en wijzigingen
- Directiebeoordeling
- Klachtenbehandeling
- Corrigerende maatregelen
- Planning van interne audits en verbetermaatregelen.
g. In het geval van onbewerkte producten moeten alle multi-site locaties in hetzelfde land of in de aangrenzende regio's van de buurlanden zijn gelegen.
1.1 Certificering
Voordat een eerste certificatieaudit kan plaatsvinden, moet een unieke certificatieovereenkomst/certificatieovereenkomst template inclusief het hoofdkantoor en de multi-site locaties worden afgesloten en ook het interne auditrapport moet beschikbaar zijn om ter beoordeling aan de Certificatie Instelling te worden overhandigd.
Nuttige tip
Indien het hoofdkantoor gecertificeerd is voor een productiescope en de multi-site locaties zijn gecertificeerd voor een transportscope en/of een handelsscope, dan moet het hoofdkantoor ook voor deze scope (transport en/of handel) worden gecertificeerd, omdat het beheer en de controle van het feed safety management system centraal op het hoofdkantoor ligt.
Auditfrequentie voor een multi-site organisatie:
- Met een hoofdkantoor en evenveel of minder dan 20 multi-site locaties, moeten alle multi-site locaties ten minste eenmaal tijdens één certificeringscyclus worden geaudit.
- Met een hoofdkantoor en meer dan 20 multi-site locaties moeten alle multi-site locaties ten minste eenmaal gedurende twee opeenvolgende certificeringscycli worden geaudit.
Het hoofdkantoor moet jaarlijks ter plaatse worden geaudit.
Indien een nieuwe multi-site locatie zich bij een multi-site organisatie voegt niet tijdens een reguliere audit, moet een beoordeling van de relevante onderwerpen op het hoofdkantoor plaatsvinden; dit kan op afstand worden gedaan. De nieuwe multi-site locatie moet worden geaudit in de huidige certificatiecyclus. Als aan de voorwaarden voor Appendix 5 en/of Appendix 6 wordt voldaan.
Minimaal verplichte audittijden in dagen voor multi-site organisaties
| Locatie | Aantal FSA-medewerkers / producten | Minimale tijdsbesteding per FSA-audit per locatie |
| Hoofdkantoor | De audittijd zoals vermeld in Appendix 2 wordt verhoogd met extra audittijd per multi-site locatie van 0,251+3 dag tot een maximum van 1,25 dag. | |
| Multi-site locatie Handel in diervoeder | ≤ 5 producten 6-15 producten >15 producten | 0,25 0,375 0,50 |
| Multi-site locatie Op- en overslag van diervoeder | | 0,25 |
| Multi-site locatie Wegtransport van diervoeder | ≤ 5 FTE2 6-15 FTE2 >15 FTE2 | 0,25 0,375 0,50 |
| Multi-site locatie Wegtransport van diervoeder, tractionair | | 0,125 |
| Multi-site locatie Bevrachting | | 0,25 |
| Multi-site locatie met zowel Op- en overslag van diervoeder als Wegtransport van diervoeder | ≤ 5 producten 6-15 producten >15 producten | 0,25 0,375 0,50 |
| Multi-site locatie met Op- en overslag van diervoeder en/of Wegtransport van diervoeder en/of Handel in diervoeder. | | 0.50 |
| 1Als de multisite een tractionair is, is 0,125 van toepassing tot een maximum van 0,625 dag. 2 Met het aantal werknemers wordt bedoeld de som van het aantal werknemers (inclusief deeltijdwerknemers als FTE-percentage) per geauditeerde multi-site locatie. 3 Als de multi-site een postbus is en/of een factuuradres is 0,063 dag van toepassing, tot een maximum van 0,315 dag, | ||
1.2 Aanvullende voorwaarden
Een transportbedrijf / tractionair kan alleen worden gecertificeerd onder multi-site voorwaarden als het transportbedrijf / de tractionair al het transport van GMP+ geborgde diervoeder exclusief voor het hoofdkantoor uitvoert. Als dit niet het geval is, moet het transportbedrijf / de tractionair onafhankelijk worden gecertificeerd.
Appendix 4B: Multi-site certificering voor handel aan veehouderijen
TS 3.1 Handel aan veehouderijen
Voor bedrijven die TS 3.1 toepassen en die extra opslaglocaties en/of extra verkooppunten of verkoopoutlets hebben, is het mogelijk om gebruik te maken van deze optie van multi-site certificering.
Er worden twee soorten Distributiecentra (DC) onderscheiden:
- DC treedt op als enige leverancier van de tussenhandelaren. In dit geval kan het DC gezien worden als onderdeel van de verkooppunten en valt dus onder de certificering voor TS 3.1. Multi-site certificering is mogelijk.
- DC is één van de leveranciers van de tussenhandelaren. DC handelt veel onafhankelijker ten opzichte van de tussenhandelaren (en vice versa) zoals vermeld onder a. DC wordt in dit geval gezien als een "gewone" handelaar en moet gecertificeerd worden voor de scope handel in diervoeder. Multi-site certificering is niet mogelijk.
1. Algemene voorwaarden
Om in aanmerking te komen voor multi-site certificering onder TS 3.1 Handel aanVeehouderijen moet de multi-site organisatie voldoen aan de volgende criteria:
- De multi-site organisatie heeft een hoofdkantoor van waaruit activiteiten worden gepland en aangestuurd.
- De multi-site organisatie beschikt over een netwerk van opslaglocaties en/of verkooppunten.
- Alle opslagplaatsen en/of verkooppunten vallen onder hetzelfde kwaliteitssysteem dat vanuit het hoofdkantoor wordt beheerd. Dit kwaliteitssysteem moet gebaseerd zijn op de GMP+ scope(s) en alle multi-site locaties moeten voldoen aan de GMP+ voorwaarden;
- Op alle multi-site locaties wordt er gewerkt volgens dezelfde methoden en procedures.
- Alle multi-site locaties zijn opgenomen in het programma van interne audits.
- Vanuit het hoofdkantoor kunnen op alle opslaglocaties en/of verkooppunten corrigerende maatregelen worden opgelegd.
- Het hoofdkantoor moet aantonen dat het in staat is om van elke multi-site locatie gegevens te verzamelen, deze te analyseren en waar nodig te wijzigen met betrekking tot:
- Systeemdocumenten en wijzigingen
- Klachtenbehandeling
- Corrigerende maatregelen
- Planning van interne audits en verbeteringsmaatregelen
- Indien het hoofdkantoor niet de eigenaar is van de extra opslaglocaties en/of extra verkooppunten, moet het hoofdkantoor beschikken over een schriftelijke overeenkomst met de multi-site locaties (opslaglocaties en/of verkooppunten) waarin zij het volgende verklaren:
- GMP+ gecertificeerde diervoeders rechtstreeks aan de veehouderijen te verkopen. Verkoop aan andere GMP+ gecertificeerde bedrijven is niet toegestaan;
- dat de aankoop van GMP+ gecertificeerde diervoeders uitsluitend via het hoofdkantoor plaatsvindt;
- volledige medewerking verlenen aan het hoofdkantoor met betrekking tot de activiteiten zoals in alle bovenstaande punten van deze optie zijn beschreven.
Deze overeenkomst moet worden ondertekend door alle tussenhandelaren die deelnemen aan deze Multi-site organisatie en de ondertekende overeenkomst moet aanwezig zijn op het hoofdkantoor en beschikbaar zijn voor de auditor ter beoordeling.
Daarnaast moeten alle multi-site locaties die een overeenkomst hebben ondertekend, bekend zijn bij de Certificatie Instelling. Op basis van deze gegevens kan de omvang van de steekproef worden bepaald.
1.1 Certificering
In het geval van Multi-site certificering voor TS 3.1 kan de auditfrequentie voor de extra opslaglocaties of extra verkooppunten (met uitzondering van het hoofdkantoor) worden verlaagd conform het volgende schema.
| Initiële certificatieaudit / hercertificatieaudit / (on)aangekondigde tussentijdse audit | |||
| Aantal multi-site locaties / verkooppunten (zonder hoofdkantoor) | 1 | 2 | > 3 |
| Aantal te auditeren multi-site locaties | 100% / 3 jaar | 100% / 3 jaar | 33% / 3 jaar |
Minimale audittijd per bezoek in dagen:
| Minimale audittijden per audit | |
| Extra opslaglocatie | 0,125 |
| Extra verkooppunt | 0,188 |
Aangezien alle opslaglocaties en/of verkooppunten volgens dezelfde methoden en procedures en onder hetzelfde kwaliteitssysteem moeten werken, kan de beoordeling van de documentatie beperkt blijven tot verificatie van de aanwezigheid van actuele documentatie en de volledigheid van de documentatie met betrekking tot de multi-site locatie.
Appendix 5: Audits op een andere locatie
Definitie:
Zie F0.2 Definitielijst
Wegtransport van diervoeder:
Voor de scope Wegtransport van diervoeder kan de aangekondigde tussentijdse en de hercertificatie audit ook op een andere locatie dan de statutaire zetel van het GMP+ gecertificeerde bedrijf plaatsvinden.Als een bedrijf optreedt als hoofdkantoor van een multi-site constructie, is de audit op een andere locatie niet toegestaan.
De volgende voorwaarden zijn van toepassing:
- Het GMP+ gecertificeerde bedrijf valt in de categorie: 1-5 FTE
- Het GMP+ gecertificeerde bedrijf heeft geen eigen werkruimte.
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf.
- Het GMP+ gecertificeerde bedrijf biedt minimaal één laadcompartiment aan die wordt gebruikt voor GMP+ transport (trailer / oplegger, etc.) voor controle;
- De alternatieve locatie is geschikt voor het uitvoeren van audits:
- Controle van laadcompartimenten veroorzaakt geen gevaarlijke situaties voor betrokkenen of omstanders.
- Als er een collectieve controle plaatsvindt (meerdere bedrijven worden tegelijkertijd voor een audit uitgenodigd), dan moet de privacy van de individuele bedrijven worden gewaarborgd.
Wegtransport van diervoeder - verplichte subscope tractionair:
Voor de scope Wegtransport diervoeder, tractionair mogen de initiële certificatieaudit, aangekondigde tussentijdse audit en hercertificatie audit ook op een andere locatie plaatsvinden dan de vestigingsplaats van het GMP+ gecertificeerde bedrijf.
De volgende voorwaarden zijn van toepassing:
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf.
- De alternatieve locatie is geschikt voor het uitvoeren van audits:
- Als er sprake is van een collectieve controle (meerdere bedrijven worden tegelijkertijd uitgenodigd voor audit) dan moet de privacy van individuele bedrijven gewaarborgd zijn.
Factuuradres:
Voor alle scopes waar “factuuradres” van toepassing is (zie F0.3 Scopes voor certificatie) mag de aangekondigde tussentijdse en hercertificatieaudit ook op een andere locatie dan de statutaire zetel van het GMP+ gecertificeerde bedrijf plaatsvinden.
De volgende voorwaarden zijn van toepassing:
- De alternatieve locatie is geschikt voor het uitvoeren van audits.
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf
Postbussen:
Voor alle scopes waar “Postbussen" van toepassing is (zie F0.3 Scopes voor certificatie) mogen de initiële certificatieaudit, aangekondigde tussentijdse audit en hercertificatie audit ook op een andere locatie plaatsvinden. Tijdens de initiële certificatieaudit heeft de Certificatie Instelling de verantwoordelijkheid om vast te stellen dat de Postbus voldoet aan de definitie van een Postbus in F0.2 Definitielijst.
De volgende voorwaarden zijn van toepassing:
- De alternatieve locatie is geschikt voor het uitvoeren van audits.
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf.
Handel in diervoeder:
Voor de van toepassing zijnde scope “Handel in diervoeder” (zie F 0.3 Scopes voor certificatie) mag de aangekondigde tussentijdse audit ook op een andere locatie plaatsvinden dan de statutaire zetel van het GMP+ Gecertificeerde Bedrijf.
De volgende voorwaarden zijn van toepassing:
- De alternatieve locatie is geschikt voor het uitvoeren van audits.
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf.
Bevrachting van diervoeder transport:
Voor de scopes Bevrachting van binnenvaart, kustvaart, railtransport, wegtransport en zeetransport kunnen de aangekondigde tussentijdse audit en hercertificatie audit ook op een andere locatie plaatsvinden dan de vestigingsplaats van het GMP+ gecertificeerde bedrijf.
De volgende voorwaarden zijn van toepassing:
- De alternatieve locatie is geschikt voor het uitvoeren van audits.
- Er zijn geen wijzigingen van toepassing op de locatie en/of activiteiten van het bedrijf.
Appendix 6: Audits op afstand
GMP + International stelt 2 soorten op afstand uit te voeren audits vast die door Certificatie-Instellingen kunnen worden gebruikt, wanneer aan de volgende voorwaarden wordt voldaan:
Als een audit wordt uitgevoerd in combinatie met een FRA-scope dan gelden de voorwaarden zoals vermeld in deze Appendix.
| Aspect | Volledige audit op afstand | Begeleide audit op afstand | |
| Toepasbaarheid | Tijdens de reguliere certificeringscyclus en | Tijdens buitengewone gebeurtenissen | Tijdens buitengewone gebeurtenissen |
| FSA Scopes |
|
|
|
| Type audit |
|
|
|
| Specifieke voorwaarden | Voorafgaand aan de audit moet de Certificatie Instelling een risicobeoordeling uitvoeren en documenteren met minstens de volgende risico's die een significante impact hebben op de audit:
Indien van toepassing, de ervaring van de laatste audit op afstand. | Dezelfde voorwaarden voor de risicobeoordeling voorafgaand aan de audit als voor de Full remote audit . | Dezelfde voorwaarden voor de risicobeoordeling voorafgaand aan de audit als voor de Full remote audit . |
| De Certificatie Instelling moet de onpartijdigheid van de begeleider waarborgen en als gedocumenteerde informatie bewaren. | |||
| Audittijd | Appendix 2 van de GMP+ CR2.0 70% van de audittijd moet worden besteed aan contact met de beoordeelde met behulp van ICT-hulpmiddelen. | Appendix 2 van de GMP+ CR2.0 70% van de audittijd moet worden besteed aan contact met de beoordeelde met behulp van ICT-hulpmiddelen. | Appendix 2 van de GMP+ CR2.0 70% van de audittijd moet worden besteed aan contact met de beoordeelde met behulp van ICT-hulpmiddelen. |
| Competenties auditteam | Competenties auditor volgens GMP+ CR1.0 | Competenties auditor volgens GMP+ CR1.0 | Competenties auditor volgens GMP+ CR1.0 |
| Het is de verantwoordelijkheid van de Certificatie Instelling om vast te stellen of de begeleider competent is. De begeleider valt tijdens de audit onder de verantwoordelijkheid van de GMP+ geaccepteerde auditor van de Certificatie Instelling en mag tijdens de audit geen conclusies trekken. | |||
| Algemene voorwaarden | Volgt de overige voorwaarden voor het certificatieproces zoals voor een reguliere on-site audit | Volgt de overige voorwaarden voor het certificatieproces zoals voor een reguliere on-site audit | Volgt de overige voorwaarden voor het certificatieproces zoals voor een reguliere on-site audit |
| 1 Als een bedrijf optreedt als hoofdkantoor voor een productielocatie(s), is de volledige audit op afstand niet toegestaan. 2 Als een bedrijf optreedt als hoofdkantoor van een multi-site constructie, is de volledige audit op afstand niet toegestaan. 3 Met uitzondering van de scopes die diervoeder fysiek verwerken: Productie (alle scopes), Op- en overslag van diervoeder, Wegtransport van diervoeder, Railtransport van diervoeder (ook niet in combinatie met een van de andere servicescopes). | |||



