1. Wprowadzenie
1.1. Zakres dokumentu
Niniejszy dokument zawiera wymogi oraz opis procesu rejestracji w celu uzyskania statusu laboratorium rejestrowanego GMP+
Nuttige tip
Patrz F0.2 Lista definicji, gdzie znajdują się definicje niektórych terminów używanych w tym dokumencie.
1.2. Stosowanie
Dokument ten obowiązuje laboratoria rejestrowane GMP+, które przeprowadzają analizy prób pasz na następujące zanieczyszczenia krytyczne:
- aflatoksyna B1;
- suma dioksyn i dioksynopodobnych PCB / dioksyny / dioksynopodobne PCB / niedioksynopodobne PCB;
- metale ciężkie (arsen, ołów, kadm i rtęć) oraz fluor;
- pestycydy
2. Wymogi dla rejestracji GMP+
Laboratorium zamierzające zostać laboratorium rejestrowanym GMP+ musi:
- Mieć wdrożony system zarządzania jakością, zweryfikowany przez stronę niezależną, który:
- Jest akceptowany w GMP+ Feed Certification scheme oraz;
- przewiduje uczestniczenie w badaniach biegłości zgodnie z wymogami z Rozdziału 5 tego dokumentu; oraz
- przewiduje stałe doskonalenie jego wydajności (kryteria zawarte są w Rozdziale 5 tego dokumentu).
- Spełnia kryteria wydajności dla laboratoriów rejestrowanych GMP+ ustanowione w Rozdziale 4 tego dokumentu.
3. Proces rejestracji
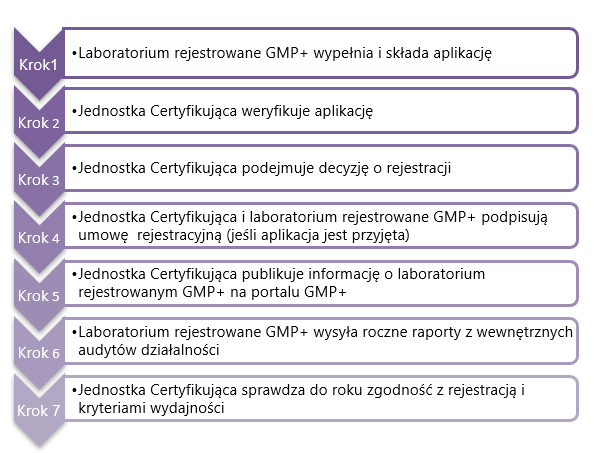
3.1. Rejestracja i ocena
Laboratorium zamierzające zostać laboratorium rejestrowanym GMP+ musi złożyć aplikację do Jednostki Certyfikującej zatwierdzonej przez GMP+ International z wnioskiem o przeprowadzenie audytów dla zakresu „Laboratorium rejestrowane’.
Laboratorium rejestrowane GMP+ musi przesłać do Jednostki Certyfikującej następujące dokumenty:
- Wypełniony formularz aplikacji.
- Aktualny wyciąg z rejestru prowadzonego przez oficjalny organ rejestrujący przedsiębiorstwa.
- Kopię ważnego certyfikatu (jeśli dotyczy), który jest akceptowany przez GMP+ Feed Certification scheme oraz kopię aktualnego zakresu certyfikacji i/lub akredytacji.
- Listę rodzajów działalności i związanych z nimi matryc, które mieszczą się w zakresie odpowiednich akceptowanych systemów laboratoryjnych.
- Ostatni raport zatwierdzający dla każdej analizy, dla której laboratorium rejestrowane GMP+ chce być zarejestrowane.
- Wyniki ostatniego programu badania biegłości dla każdej analizy, dla której laboratorium rejestrowane GMP+ chce być zarejestrowane.
- W przypadku podzlecania analizy laboratorium rejestrowanemu GMP+, dokumentację wykazującą, że wykonujące zlecenie laboratorium rejestrowane GMP+ jest zarejestrowane dla przedmiotowej analizy.
- W przypadku podzlecania, kontrakt pomiędzy laboratorium rejestrowanym GMP+ i przyjmującym zlecenie laboratorium rejestrowanym GMP+, w którym określone są zasady ich współpracy.
Po złożeniu kompletnego wniosku oraz wszystkich wymaganych dokumentów, Jednostka Certyfikująca przeprowadzi jego ocenę.
3.2. Decyzja dotycząca rejestracji
Jednostka Certyfikująca, w ciągu 6 tygodni po otrzymaniu aplikacji, poinformuje laboratorium rejestrowane GMP+ pisemnie o (nie-) zgodności z wymogami z tego dokumentu.
Jeśli aplikacja jest przyjęta, należy zawrzeć umowę rejestracyjną, którą muszą podpisać Jednostka Certyfikująca i laboratorium rejestrowane GMP+.
Po otrzymaniu podpisanej przez obie strony umowy rejestracyjnej, Jednostka Certyfikująca publikuje wszystkie właściwe informacje o laboratorium rejestrowanym GMP+ w bazie danych GMP+ Company database i wystawia oświadczenie o spełnieniu wymogów laboratorium rejestrowanemu GMP+.
3.3. Informowanie Jednostki Certyfikującej
Laboratorium rejestrowane GMP+ musi aktualizować przekazane Jednostce Certyfikującej informacje i dowody wymagane w Rozdziale 2 oraz § 3.1 powyżej.
Przynajmniej raz w roku laboratorium rejestrowane GMP+ musi przesłać wyniki swojego audytu wewnętrznego do Jednostki Certyfikującej, aby umożliwić weryfikację, czy jego wydajność spełnia wymogi ustanowione w Rozdziałach 4 i 5 tego dokumentu.
4. Kryteria wydajności dla badań laboratoryjnych
| Maksymalne limity dla kryteriów wydajności są podawane w: | |
| mg/kg (ppm)* | Aflatoksyna B1 Metale ciężkie Fluor Pestycydy |
| ng TEQ/kg* | Suma dioksyn i dioksynopochodnych PCB Dioksyny Dioksynopodobne PCB |
| µg/kg* | Niedioksynopodobne PCB |
| | |
* Uzyskane dla wilgotności na poziomie 12% (88% suchej masy).
Nuttige tip
Patrz Appendix 1 z tego dokumentu, który należy stosować przy wyliczaniu kryteriów wydajności omawianych w tym dokumencie.
4.1. Aflatoksyna B1
| Matryca | Granica oznaczalności (LOQ) (mg/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru | ||
| Materiały paszowe | 0,001 | 25% | 15% | 60% | ||
| Pasze uzupełniające i pełnoporcjowe, za wyjątkiem pasz dla: | 0,005 | 25% | 15% | 60% | ||
| | Bydła mlecznego i cieląt | 0,001 | 25% | 15% | 60% | |
| | Owiec mlecznych i jagniąt | 0,001 | 25% | 15% | 60% | |
| | Kóz mlecznych i koźląt | 0,001 | 25% | 15% | 60% | |
| | Prosiąt | 0,001 | 25% | 15% | 60% | |
| | Młodego drobiu | 0,001 | 25% | 15% | 60% | |
| Mieszanki paszowe dla: | | | | | ||
| | Bydła (oprócz bydła mlecznego i cieląt) | 0,004 | 25% | 15% | 60% | |
| | Owiec (oprócz owiec mlecznych i jagniąt) | 0,004 | 25% | 15% | 60% | |
| | Kóz (oprócz kóz mlecznych koźląt) | 0,004 | 25% | 15% | 60% | |
| | Świń (oprócz prosiąt) | 0,004 | 25% | 15% | 60% | |
| | Drobiu (oprócz młodych zwierząt) | 0,004 | 25% | 15% | 60% | |
Nuttige tip
Do metod odpowiednich do analizy aflatoksyny B1 zazwyczaj zalicza się wysokosprawną chromatografię cieczową (HPLC) w połączeniu z detekcją fluorescencyjną lub spektrometrią mas (MS). Dozwolone są wszystkie analityczne metody ilościowe, o ile nie zostaną przekroczone zadane wartości graniczne. Jeśli czyszczenie odbywa się w kolumnie immunopowinowactwa, odzysk aflatoksyny B1 powinien przekraczać 80% i być regularnie sprawdzany dla analizowanych matryc. Ze względu na zdolność aflatoksyny do adsorbowania na szkle należy korzystać ze szkła laboratoryjnego płukanego kwasem.
Nuttige tip
Do celów przesiewowych można stosować metody półilościowe, na przykład chromatografię cienkowarstwową (TLC), testy ELISA itp., w takim jednak przypadku konieczne jest potwierdzenie podejrzenia niezgodności wyniku. Norma NEN-EN-ISO 6498 zawiera wytyczne dotyczące przygotowania próbek badawczych. W celu zbadania próbki laboratoryjnej na obecność mykotoksyn całą próbkę należy poddać zmieleniu. Norma NEN-ISO 14718 określa metodę stwierdzania obecności aflatoksyny B1 w paszy dla zwierząt z wykorzystaniem chromatografii HPLC z detekcją fluorescencji po derywatyzacji postkolumnowej.
Nuttige tip
W trakcie całej procedury transportowania próby, przygotowywania próby oraz jej analizy, próbę należy w jak największym stopniu chronić przed działaniem promieni słonecznych, ponieważ aflatoksyna ulega stopniowemu rozkładowi pod wpływem promieniowania nadfioletowego. Ponieważ rozkład aflatoksyny w materiale jest wysoce niejednorodny, próby należy przygotowywać – a zwłaszcza homogenizować - z zachowaniem najwyższej staranności, np. metodą zawiesinową (ref).
4.3. Suma dioksyn i dioksynopodobnych PCB
| Matryca | Granica oznaczalności (LOQ) (ng TEQ/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru |
| Materiały paszowe | 0,2* | 15% | 20% | 50% |
| Dodatki paszowe i premiksy | 0.3 | 15% | 20% | 50% |
| Mieszanki paszowe za wyjątkiem | 0.30 | 15% | 20% | 50% |
| Mieszanki paszowe dla zwierząt domowych i ryb | 0.75 | 15% | 20% | 50% |
| * limitu z GMP+TS1.5 | ||||
Nuttige tip
Rozporządzenie Komisji UE nr 2017/644 ustanawiające metody pobierania i analizy prób do celów kontroli poziomów dioksyn i dioksynopodobnych polichlorowanych bifenyli (PCB) opisuje szczegółowo środki ostrożności, jakie powinny podejmować laboratoria badające próby na obecność dioksyn oraz wyznacza normy dla tego typu badań. W rozporządzeniu rozróżnia się metody przesiewowe i potwierdzające.
Metody przesiewowe są wykorzystywane do wybierania prób, w których poziomy dioksyn (PCDD/F) i dioksynopodobnych polichlorowanych bifenyli (PCB) przekraczają maksymalne dopuszczalne poziomy lub poziomy reagowania. Pozwalają one na względnie tanie i szybkie oznaczanie dużej liczby prób, zwiększając w ten sposób szansę wykrycia nowych przypadków z wysokim poziomem narażenia i ryzykiem dla zdrowia konsumentów. Metody przesiewowe powinny opierać się na metodach bioanalitycznych i metodach GC/MS.
Wyniki uzyskane dla prób przekraczających wartość odcięcia powinny zostać potwierdzone przez przeprowadzenie ponownej pełnej analizy przy zastosowaniu metody potwierdzającej w celu sprawdzenia ich zgodności z maksymalnym dopuszczalnym poziomem.
Metody potwierdzające dostarczają pełnych lub uzupełniających informacji, dzięki którym można jednoznacznie zidentyfikować związki PCDD/F i dioksynopodobne PCB oraz określić ich ilość w próbie przy najwyższych dopuszczalnych poziomach lub w razie konieczności przy poziomie reagowania. W metodach tych wykorzystuje się chromatografię gazową sprzężoną ze spektrometrią mas o wysokiej rozdzielczości (GC-HRMS) lub chromatografię gazową sprzężoną z potrójną kwadrupolową spektrometrią mas (GC-MS/MS).
Nuttige tip
W ocenie kongenerów dioksyn w zakresie od tetra do okta należy opierać się na protokołach nr 1613 United States Environmental Protection Agency (Amerykańskiej Agencji Ochrony Środowiska) oraz zharmonizowanym protokole europejskim EN 16215:2012. Protokoły te opisują podstawy regulacji i kalibracji sprzętu oraz kryteria identyfikacji i oceny ilościowej w rozcieńczaniu izotopowym oraz procedury oceny jakościowej i kontroli jakości. W skład rutynowej procedury, np. oceny odzysku wzorców wewnętrznych, dokładności prób wzorcowych oraz ślepych, powinien wchodzić standardowy program zapewniania jakości (QA).
Nuttige tip
Do wyrażenia potencjału toksycznego mieszaniny dioksyn użyto współczynnika równoważnego toksyczności (TEF). Dioksynom przypisano wartość TEF, która odpowiada ich względnemu potencjałowi toksycznemu w odniesieniu do 2,3,7,8-TCDD, najbardziej toksycznego kongeneru pośród dioksyn, dla którego wartość TEF wynosi 1,0. Wartość toksyczności kongeneru (ng TEQ/kg produktu) obliczano, mnożąc wartość TEF dla każdego z kongenerów przez stężenie tego kongeneru w ng/kg produktu. Łączną wartość TEQ dla każdej próbki wyznacza się, sumując wartości TEQ dla wszystkich kongenerów.
Nuttige tip
Ustawodawstwo europejskie dopuszcza stosowanie metod bioanalitycznych, na przykład oznaczenia CALUX (Chemically Activated LUciferase gene eXpression - aktywowanej chemicznie ekspresji genu lucyferazy) w badaniach przesiewowych prób paszy, w celu wskazania podwyższonych poziomów PCDD/F i DL-PCB. Wyniki badań przesiewowych porównuje się ze stężeniem odcięcia, dzięki czemu analityk może określić zgodność próby oraz zidentyfikować te z prób, które wymagają dalszego badania metodami analizy potwierdzającej. Ponadto wyniki badania przesiewowego mogą stanowić liczbowe wskazanie poziomów TEQ dla PCDD/F i dioksynopodobnych PCB w próbce. Wyrażenie wyników bioanalizy w postaci BEQ jest szczególnie przydatne dla analityka przeprowadzającego badanie kontrolne metodami potwierdzającymi, ale podczas wstępnego procesu walidacji jest obowiązkowe.
Nuttige tip
Laboratoria stosujące bioanalizę w ramach oficjalnej kontroli lub z innych wskazanych przepisami prawa przyczyn, muszą mieć akredytację zgodną z normą EN ISO/IEC 17025. Skutkiem tego stosowane metody muszą zostać zwalidowane w celu zapewnienia dowodu ich zgodności z wymogami prawnymi obowiązującymi w UE, zgodnie z rozporządzeniami Komisji (UE) 2017/644 i 152/2009 (wraz ze zmianami). Kompetencje laboratorium powinny zostać potwierdzone za pomocą wewnętrznych i zewnętrznych środków kontroli jakości. Stałe i efektywne uczestnictwo w badaniach międzylaboratoryjnych opartych na analizach PCDD/F i dioksynopodobnych PCB w odnośnych matrycach pasz / żywności jest obowiązkowe
Nuttige tip
Metoda przesiewowa z zasady klasyfikuje próbę jako zgodną lub podejrzaną o niezgodność. W tym celu wyliczony poziom BEQ jest porównywany z wartością odcięcia. Próby z BEQ poniżej wartości odcięcia są uznawane za zgodne, próbki, dla których BEQ jest równy lub wyższy wartości odcięcia, są podejrzewane o niezgodność i przekazywane do analizy metodą potwierdzającą.
Ustalone granice mają zastosowanie dla obu rodzajów metod. Metody potwierdzające należy stosować w przypadku, gdy wyniki przekraczają normy określone w dokumencie GMP+ TS1.5 Szczegółowe limity bezpieczeństwa pasz.
W przypadku ustalenia indywidualnych limitów dla dioksyn lub PCB laboratorium musi przedstawić dowody dotyczące różnych zestawów kryteriów wydajności.
Laboratorium dostarczy wartości TEQ odpowiadające brzegowi dolnemu i górnemu. Próbę, dla której ustalone przepisami prawa wartości graniczne zostały przekroczone, uznaje się za potwierdzoną, jeśli różnica między brzegiem dolnym a brzegiem górnym wartości TEQ jest < 20%. Lot jest niezgodny z poziomem maksymalnym ustanowionym w rozporządzeniu (WE) nr 1881/2006, jeśli wynik analityczny oparty na górnym brzegu został uzyskany metodą potwierdzającą i został potwierdzony powtórną analizą.
Powtórna analiza jest wymagana, aby wykluczyć możliwość wewnętrznego zanieczyszczenia krzyżowego próbki lub przypadkowego zmieszania prób. Pierwsza analiza, uwzględniająca niepewność pomiaru, jest wykorzystywana do weryfikacji zgodności.
W przypadku analizy przeprowadzanej w ramach incydentu związanego z zanieczyszczeniem można pominąć potwierdzenie powtórną analizą, jeśli próby wybrane do analizy zostały powiązane z incydentem związanym z zanieczyszczeniem dzięki identyfikowalności.
Kryteria wydajności podane w powyższych tabelach zostały oparte na łącznym brzegu górnym TEQ.
4.4. Dioksyny
| Matryca | Granica oznaczalności (LOQ) (ng TEQ/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru |
| Materiały paszowe | 0,2* limitu z GMP+ TS6 | 15% | 20% | 50% |
| Dodatki paszowe i premiksy | 0.2 | 15% | 20% | 50% |
| Mieszanki paszowe za wyjątkiem: | 0.15 | 15% | 20% | 50% |
| Mieszanki paszowe dla zwierząt domowych i ryb | 0.25 | 15% | 20% | 50% |
Nuttige tip
Wskazówki 1 – 6 znajdujące się w § 4.2 mogą również być przydatne przy przeprowadzaniu analiz na dioksyny.
4.4.1. Granica oznaczalności (LOQ) bioanalizy
W przypadku bioanalitycznej metody przesiewowej ustanowienie granicy oznaczalności nie jest niezbędne, ale należy dowieść, że metoda pozwala na rozróżnienie między ślepą próbą a wartością odcięcia. Podając poziom BEQ, należy ustalić poziom zgłaszania, aby uwzględnić próby wykazujące odpowiedź poniżej tego poziomu.
Poziom zgłaszania:
- musi być różny od procedury próby ślepej co najmniej o współczynnik 3, przy odpowiedzi poniżej zakresu roboczego,
- w związku z tym należy go obliczyć z prób zawierających związki docelowe w granicach wymaganego poziomu minimalnego, a nie ze stosunku S/N lub z próby ślepej.
Granica oznaczalności bioanalizy musi być jednak taka, że poziom BEQ odpowiadający 2/3 maksymalnego poziomu musi stanowić najbardziej odpowiednią wartość odcięcia, zapewniającą odsetek wyników fałszywie zgodnych poniżej 5% oraz akceptowalny odsetek wyników fałszywie niezgodnych.
4.5. Dioksynopodobne PCB
| Matryca | Granica oznaczalności (LOQ) (ng TEQ/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru |
| Materiały paszowe | 0.4 | 15% | 20% | 50% |
| Dodatki paszowe i premiksy | 0.4 | 15% | 20% | 50% |
| Mieszanki paszowe za wyjątkiem: | 0.15 | 20% | 20% | 50% |
| Mieszanki paszowe dla zwierząt domowych i ryb | 0,5 | 10% | 20% | 45% |
Nuttige tip
Wskazówki 1 – 6 znajdujące się w § 4.2 mogą również być przydatne przy przeprowadzaniu analiz na dioksynopodobne PCB.
4.6. Niedioksynopodobne PCB
| Matryca | Granica oznaczalności (LOQ) (µg/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru |
| Materiały paszowe | 3.33 | 15% | 20% | 50% |
| Dodatki paszowe i premiksy | 3.33 | 15% | 20% | 50% |
| Mieszanki paszowe za wyjątkiem: | 3.33 | 15% | 20% | 50% |
| Mieszanki paszowe dla zwierząt domowych i ryb | 10 | 15% | 20% | 50% |
4.8. Metale ciężkie i fluor
| Matryca | Granica oznaczalności LOQ) (mg/kg 88% suchej masy) | Odtwarzalność | Odchylenie | Niepewność rozszerzona pomiaru | ||
| Materiały paszowe m.in minerały: | ||||||
| Arsen (As) łącznie | 0.4 | 25% | 15% | 60% | ||
| Ołów (Pb) | 1.0 | 20% | 15% | 50% | ||
| Kadm (Cd) | 0.2 | 20% | 15% | 50% | ||
| Rtęć (Hg) | 0.02 | 25% | 20% | 65% | ||
| Fluor (F) | 30 | 10% | 15% | 35% | ||
| Dodatki paszowe i premiksy: | ||||||
| Arsen (As) łącznie | 6.0 | 20% | 10% | 45% | ||
| Ołów (Pb) | 6.0 | 15% | 10% | 40% | ||
| Kadm (Cd) | 0.4 | 15% | 10% | 40% | ||
| Pasze uzupełniające i pełnoporcjowe: | ||||||
| Arsen (As) łącznie | 0.4 | 25% | 10% | 60% | ||
| Ołów (Pb) | 1.0 | 20% | 10% | 45% | ||
| Kadm (Cd) | 0.1 | 20% | 10% | 45% | ||
| Rtęć (Hg) | 0.02 | 25% | 20% | 60% | ||
| Fluor (F)* | 6.0 | 10% | 15% | 35% | ||
| * Chociaż nie jest to metal ciężki, LOQ dla fluoru są również brane pod uwagę. | ||||||
Nuttige tip
Istnieje wiele odpowiednich metod analizy zawartości metali ciężkich regulowanych przepisami prawa — kadmu (Cd), arsenu (As), ołowiu (Pb) i rtęci (Hg) — takich jak:• Spektrometria atomowa emisyjna z indukcyjnie sprzężoną plazmą (ICP-OES)• spektroskopia mas z indukcyjnie sprzężoną plazmą (ICP-MS) • Atomowa spektrometria absorpcyjna z atomizacją w piecu grafitowym (GF-AAS). W przypadku wyników uzyskiwanych w ICP-OES granica oznaczalności zazwyczaj jest podawana w mg/kg, podczas gdy w przypadku GF-AAS lub ICP-MS dla większości metali ciężkich granice oznaczalności są znacznie niższe. Metody te można zasadniczo stosować do analizy niewielkich ilości prób, które wymagają dobrej homogenizacji (< 0,5 mm2) i następującego po niej pełnego trawienia matrycy za pomocą np. HNO3.
W przypadku ICP-MS zaleca się zdecydowanie korzystanie z tak zwanej technologii cel kolizyjno-reaktywnych w celu usunięcia interferencji wieloatomowych, na przykład pochodzących od ArCl+, których obecność mogłaby skutkować uzyskaniem wyników fałszywie dodatnich
Nuttige tip
Obecność rtęci można wykrywać właściwymi do tego celu metodami na przykład: bazującymi na rozkładzie termicznym próbki, amalgamacji rtęci i wykrywaniu absorpcji atomowej. Granica oznaczalności przy zastosowaniu tej techniki jest bardzo niska. Ponieważ pobierane próby są niewielkie, zazwyczaj do 0,1 grama, również w przypadku tych metod próbę należy dobrze zhomogenizować (< 0,5 mm2). Z tak zhomogenizowanej próbki należy wytrawić w kwasie lub piecu muflowym podpróbę o masie zasadniczo od 0,1 do 1 grama.
Dozwolone są wszystkie analityczne metody ilościowe, o ile nie zostaną przekroczone zadane wartości graniczne. Granica wykrywalności metody dla każdej z metod oznaczania i dla każdego z pierwiastków zależy od matrycy próbek oraz od użytego sprzętu i wykorzystanej technologii.
Nuttige tip
Obecność fluoru może zostać oznaczona po przetworzeniu w kwasie solnym z użyciem spektroskopii lub elektrody jonoselektywnej.
Nuttige tip
W przypadku wyniku analizy powyżej lub w pobliżu maksymalnego limitu zaleca się powtórzenie analizy przy użyciu świeżych prób i kwantyfikacji opartej na „dodaniu wzorca” poprzez dodanie dwóch podpróbek na dwóch różnych poziomach, np. jeden tylko 0,5 * ML (maksymalnego limitu) i jeden 1,5 * ML. Dzięki zastosowaniu dodatku wzorca efekty matrycy specyficzne dla próby są zminimalizowane.
4.9. Pestycydy
Laboratorium musi wykazać spełnianie kryteriów wydajności dla analiz wszystkich parametrów pestycydów podanych w tabeli poniżej, aby mogło zostać zarejestrowane.
| Parametry | LOQ (mg/kg 88% DM ) | Odtwarzalność | Odchylenie1 | Niepewność rozszerzona pomiaru |
| Aldryna | 0.01 | 20% | 70-120% | 50% |
| Dieldryna | 0.01 | 20% | 70-120% | 50% |
| Chlordan (suma izomerów cis- i trans- i oksychlordanu wyrażona jako chlordan) | 0.01 | 20% | 70-120% | 50% |
| DDT (suma p,p´-DDT, o,p´-DDT, p-p´-DDE p,p´-TDE (DDD) wyrażana jako DDT) | 0.05 | 20% | 70-120% | 50% |
| Endosulfan (suma izomerów alfa- i beta- oraz siarczanu endosulfanu wyrażona jako endosulfan) | 0.01 | 20% | 70-120% | 50% |
| Endryna (suma endryny i delta-keto-endryny, wyrażona jako endryna) | 0.01 | 20% | 70-120% | 50% |
| Heptachlor (suma heptachloru i epoksydu heptachloru, wyrażona jako heptachlor) | 0.01 | 20% | 70-120% | 50% |
| Heksachlorobenzen (HCB) | 0.01 | 20% | 70-120% | 50% |
| Heksachlorocykloheksan (HCH) | | | 70-120% | 50% |
| - izomery alfa | 0.01 | 20% | 70-120% | 50% |
| - izomery beta | 0.01 | 20% | 70-120% | 50% |
| - izomery gamma | 0.01 | 20% | 70-120% | 50% |
| Fipronil (suma fipronilu + metabolit sulfonu (MB46136) wyrażona jako fipronil) | 0.005 | 20% | 70-120% | 50% |
| Chlorpiryfos metylowy | 0.01 | 20% | 70-120% | 50% |
| Pirymifos metylowy | 0.01 | 20% | 70-120% | 50% |
| Cypermetryna (cypermetryna, w tym inne mieszaniny izomerów składowych (suma izomerów)) | 0.05 | 20% | 70-120% | 50% |
| Tebukonazol | 0.02 | 20% | 70-120% | 50% |
| Deltametryna (cis-deltametryna) | 0.02 | 20% | 70-120% | 50% |
| Chlorprofam | 0.01 | 20% | 70-120% | 50% |
| Chlorpiryfos etylowy | 0.01 | 20% | 70-120% | 50% |
| Difenyloamina | 0.05 | 20% | 70-120% | 50% |
| Malation (suma malationu i malaoksonu wyrażona jako malation) | 0.02 | 20% | 70-120% | 50% |
| Permetryna (suma izomerów) | 0.05 | 20% | 70-120% | 50% |
| 1 W wyjątkowych wypadkach, wskaźniki średniego odzysku poza przedziałem 70-120% mogą być zaakceptowane, o ile są spójne (RSD ≤ 20 %) a ich podstawa jest dobrze ugruntowana (np. z uwagi na rozmieszczenie analitu w etapie podziału), ale średni odzysk nie może być niższy od 30% ani wyższy niż 140%. | ||||
Nuttige tip
Można skorzystać z dokumentu wsparcia S 9.13 Managing pesticide residues, aby ustalić prawidłowy MRL Dokument ten opisuje i odpowiada na pytania od firm certyfikowanych GMP+ dotyczące wymogów w GMP+ FC scheme odnośnie obowiązujących MRL dla pestycydów w paszach.
Nuttige tip
Kryteria wydajności ustanowione w tym rozdziale są oparte na dokumencie SANTE 12682/2019 (https://www.eurl-pesticides.eu/docs/public/tmplt_article.asp?CntID=727).
Nuttige tip
Większość pestycydów, podlegających kontroli można analizować za pomocą tak zwanej metody QuEChERS (Quick Easy Cheap Effective Rugged Safe). Metoda ta bazuje na ekstrakcji za pomocą acetonitrylu w obecności wody, po której następuje separacja, kontrolowana za pomocą mieszanki MgSO4 i NaCl, fazy wodnej. Następnie faza acetonitrylu może być analizowana przy użyciu GC-MS i LC-MS/MS obejmującej szeroki zakres pestycydów o różnych właściwościach fizycznych i chemicznych. Dla niektórych pestycydów potrzebna jest specjalna metoda (pojedynczy związek), np. ditiokarbamininany. Dla związków o dużej polarności metody oparte na tak zwanej QuPPe (Quick Polar Pesticides Method). Patrz również : http://www.crl-pesticides.eu/docs/public/tmplt_article.asp?CntID=887&LabID=200&Lang=EN
5. Doskonalenie
5.1. Informacje ogólne
Laboratorium rejestrowane GMP+ musi uczestniczyć w badaniach biegłości, aby potwierdzić swoje aktualne kompetencje. Badanie biegłości musi służyć monitorowaniu stałej wydajności laboratorium.
Badanie biegłości musi przynajmniej spełniać wymogi określone w § 5.2 – 5.5.
5.2. Badania biegłości
Raz w roku, laboratorium rejestrowane GMP+ musi wziąć udział w badaniu biegłości dla każdej analizy, dla której jest ono zarejestrowane. Laboratorium rejestrowane GMP+ musi upewnić się, że ogranizator badania biegłości przeprowadza badanie biegłości zgodnie z ** ISO 17043.
Jeżeli badanie biegłości nie jest dostępne, wydajność analiz musi być wykazana za pomocą:
- certyfikowanego materiału referencyjnego, lub
- gdy nie jest on dostępny:
- materiału referencyjnego z poprzednich badań biegłości lub
- próby wzorcowej.
** Oznacza to, że organizator nie musi być akredytowany, lecz musi przeprowadzać badanie biegłości zgodnie z ISO 17043.
5.3. Planowanie
Raz w roku laboratorium rejestrowane GMP+ musi sporządzić plan badań biegłości, w których będzie uczestniczyć. Plan ten musi być zachowany jako informacja udokumentowana.
5.4. Administracja
Wyniki badań biegłości laboratorium rejestrowanego GMP+ muszą być zachowywane jako informacje udokumentowane przez przynajmniej 3 lata.
Wynik laboratorium rejestrowanego GMP+ musi być wyrażony jako ‘z-score’.
Nuttige tip
‘Z-score’ odzwierciedla:
- faktycznie osiągniętą dokładność (różnica pomiędzy wynikiem laboratorium, a przyjętą wartością prawdziwą lub uzgodnioną) oraz
- ocenę organizatora badania biegłości odnośnie zgodności stopnia dokładności z założonym celem.
5.5. Interpretacja wyników badania biegłości
Laboratorium rejestrowane GMP+ musi interpretować wyniki badania biegłości w oparciu o limity podane w tabeli poniżej.
| Z-score | Ocena |
| Z ≤ 2 | Zadowalająca |
| 2 < Z < 3 | Wątpliwa |
| Z ≥ 3 | Niezadowalająca |
W przypadku, gdy z-score jest oceniony jako wątpliwy lub niezadowalający, laboratorium rejestrowane GMP+ musi:
- przeprowadzić dochodzenie dotyczące prawdopodobnej przyczyny (przyczyn) odchylenia, oraz
- zastosować środki naprawcze oraz
- zweryfikować, czy środki naprawcze prowadzą do zadowalającej wydajności.
Appendix 1 Wyliczenia
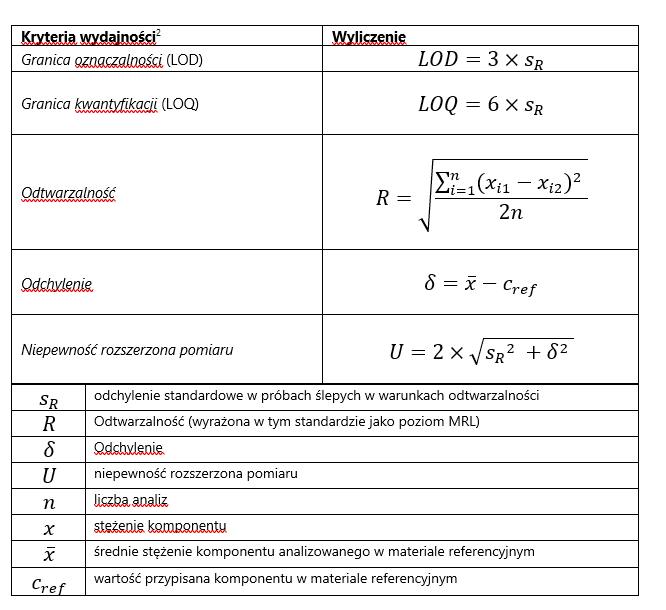
² Definicje i wyliczenia pochodzą z NEN 7777: Prestatiekenmerken van meetmethoden and NEN 7779: Meetonzekerheid
Średnie odchylenie metody jest otrzymywane z certyfikowanego materiału referencyjnego lub z materiału z badań biegłości z przypisaną wartością (konsensus). Odchylenie oparte na dodatku jest akceptowalne, gdy nie jest spodziewana interferencja z matrycą. Dodatek to przynajmniej osiem różnych matryc prób używanych przy wyliczeniu odchylenia z wyliczonego odzysku (dokładność).
Risk Management tools
That was a lot of information to digest and one might ask, what is the next step? Luckily we can offer support for the GMP+ Community when doing this. We provide support by means of various tools and guidances but as each company has a shared responsibility to feed safety, and therefor tailor-made solutions cannot be offered. However, we do help by explaining requirements and provide background information about the requirements.
We have developed various supporting materials for the GMP+ Community. These include various tools, ranging from Frequently Asked Questions (FAQ) lists to webinars and events.
Supporting materials related to this document (Guidelines and FAQ’s)
We have made documents available which give guidance to the GMP+ requirements as laid down in the module GMP+ FSA and GMP+ FRA. These documents give examples, answers to frequently asked questions or background information.
Where to find more about the GMP+ International Risk Management tools? Fact sheets More information: GMP+ Platform Product list More information: Product List Risk Assessments More information: GMP+ Platform GMP+ Monitoring database More information: GMP+ Monitoring database Support documents More information: Support documents |



